1) Для нахождения концентрации нам необходимо знать массу вещества и массу раствора по формуле :
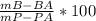
м вещества = масса исходного в-ва + масса добавленного = 100+50 =150г
м раствора ищется также, получается 1200
w= \frac{150}{1200} *100%" alt=" = w" />
м вещества = масса исходного в-ва + масса добавленного = 100+50 =150г
м раствора ищется также, получается 1200
w= \frac{150}{1200} *100%" /> = 12,5%
ответ: 12,5
2) В данной задаче нам не дана масса исходного вещества, мы её находим по формуле:
m в-ва= w * m р-ра / 100%
Получается, что масса вещества = 400*0,15=60 г
Теперь мы можем найти концентрацию получившегося раствора по известной нам формуле
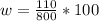 = 13,75%
= 13,75%
ответ: 13,75
3) Здесь нам не известны две массы в-ва, однако дано все остальное, по формуле мы можем найти исходную и добавленную массы
m в-ва₁= 0,5*400= 200 г
m в-ва₂=0,5*200 = 100 г
Теперь находим концентрацию
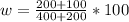 = 50%
= 50%
ответ:50
SrCl2 + Na2SO4 = 2NaCl + SrSO4(в осадок)
2HCl + Na2SO3 = 2NaCl + SO2 + H2O