Оксиды и соли самые распространенные соединения, большинство элементов на поверхности Земли можно встретить в виде оксида либо соли.
Окиси железа (II) и (III)
Окись кремния
Окись водорода (просто вода)
Окись алюминия
Окись углерода (IV) - углекислый газ
Соли не буду перечислять.
Что касается оснований, они встречаются куда реже
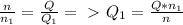
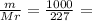 4,4 моль
4,4 моль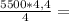 6,050 кДЖ
6,050 кДЖ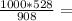 581,5г
581,5г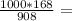 185г
185г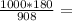 198,25г
198,25г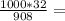 35,25г
35,25г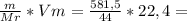 296л
296л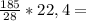 148л
148л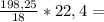 246,7л
246,7л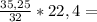 24,675л
24,675лТо есть концентрация полученного раствора должна стать: 15 + 5 = 20%
1) Если концентрацию раствора выразить в долях единицы, то массу растворенного вещества в граммах находят по формуле:
m(в-во) = ω * m(p-p)
где: m(p-p) - масса раствора в граммах, ω - массовая доля растворенного вещества, выраженная в долях единицы .
15% - это 0,15 в долях единицы, а 20% - 0,2
2) Обозначим массу раствора после упаривания через Х граммов. Так как при упаривании масса растворенного вещества не изменяется, то можем записать:
0,18 · 800 = 0,2 · Х
0,2Х = 120
Х = 600
3) То есть масса раствора была 800 г, а стала 200 г. Значит количество выпаренной воды равно:
800 - 600 = 200 г
ответ: 200 г воды
Оксиды широко распространены в природе. В очень больших кол-вах встречаются Н2О и SiO2.Многие оксиды образуются при взаимод. простых в-в с кислородом (Li2O, СаО, La2O3, SO2 и др.). Оксидыметаллов обычно получают термич. разложением гидроксидов, карбонатов, нитратов и др. солейкислородсодержащих к-т (напр., СаСО3 СаО + СО2), анодным окислением металлов, оксиды неметаллов -окислением кислородом водородсодержащих соед. неметаллов (напр., 2H2S 4+ 3О2 2SO2 + 2H2O). В пром-сти в больших кол-вах получают СаО, Аl2О3, MgO, SO3, CO, CO2, NO и другие оксиды. Используют оксиды какогнеупоры (SiO2, MgO, Al2O3 и др.), адсорбенты (SiO2-сшгака-гель, Аl2О3 и др.), катализаторы (V2O5, Al2O3 и др.), в произ-ве строит. материалов, стекол, фарфора, фаянса, магн. материалов, пьезоэлектриков и др. Оксиды металлов (Fe, Ni, Al, Sn и др.)-сырье в произ-ве металлов, оксиды неметаллов (напр., S, Р, N)- в произ-ве соответствующих к-т.