Fe2O3 + 6HCl = 2FeCl3 + 3H2O
M(Fe2O3)=160г/моль
n(Fe2O3)=9.6/160=0.06моль => n(HCl) = 0.06*6=0.36моль
M(HCl)=36.5г/моль
m(HCl)=M*n=36.5*0.36=13.14г
m(р-ра)=13.14/0.146=90г
Фтор – элемент, относящийся к группе галогенов. Неметалл. Расположен во втором периоде VII группы A подгруппы.
Атом фтора имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы – VII (галогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 7 валентных электронов и до завершения внешнего энергетического уровня не хватает всего одного электрона. Обладает самой высокой окислительной среди всех элементов Периодической системы.Условное изображение строения атома фтора
https://ru-static.z-dn.net/files/d67/d646eded0e2dd73ca5636cb90eea927c.jpg
Рис. 1. Условное изображение строения атома фтора.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p5.
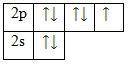
Фтор – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
https://ru-static.z-dn.net/files/d74/45577a2d36e79463f2cccd9a8fe3a6ad.jpg
Энергетическая диаграмма для валентных электронов
У фтора есть 3 пары спаренных электронов и один неспаренный электрон. Во всех своих соединениях фтор проявляет валентность I и степень окисления -1.
В результате взаимодействия фтор является акцептором электронов. В этом случае атом превращается в отрицательно заряженный ион (F—):
F0 +e →F—.
Объяснение:

Уксусная кислота вступает в реакции с различными веществами. И благодаря подобным реакциям, становится возможным: образование солей, амидов и сложных эфиров.
В химической промышленности из нее производят пластические массы, различные красители, лекарственные вещества, искусственное волокно (ацетатный шелк), негорючей кинопленку. Соли уксусной кислоты — ацетаты алюминия, хрома, железа — применяют как протраву при окрашивании тканей.
Уксусная кислота имеет широкое применение как растворитель. В пищевой промышленности применяется как консервирующее средство и вкусовая приправа.
Дано: |
m(Fe2O3) = 9,6 г |
w(HCl)= 14,6% |
|
m(HCl) - ? |
9,6 х
Fe2O3 + 6HCl(г) = 2FeCl3 + 3H2O
160 216
По реакции находим массу HCl чистого.
x=9,6*216/160 = 12,96 г
Находим массу раствора HCl.
m(HCl) = 12,96/0,146= 89 г
ответ: m(HCl) = 89 г