х г у г 1 000 000 г
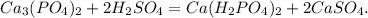
310 г 196 г 506 г
1. Сначала определим чистые массы фосфата и кислоты:
при взаимодействии 310 г фосфата образуется суперфосфата 506 г, а
при --//--//-- х г________________________________1000000 г, откуда
х=310*1000000/506=612 648 г
при взаимодействии 196 г кислоты образуется 506 г суперфосфата, а
при --//--//-- у г___________________1000000 г, откуда
у=196*1000000/506=387 352 г
2. Если брать массу фосфата, а она - 612 648 г - это 90%, а
k г фосфорита - это 100%, откуда
k=612 648*100/90=680 720 г или приблизительно 681 кг
3. Если масса кислоты, а она составляет 387 352 г - это 80%, а
l г раствора - это 100%, откуда
l=387 352*100/80=484 190 г
Чтобы найти объем раствора(для этого и дана,наверное,плотность раствора),то массу поделим на плотность:
V(раствора)=m/p=484 190/1,73=279 879 мл или приблизительно 280 л
2H3PO4+3Ca(OH)2=6H2O+Ca3(PO4)2-обязательно нужны коэффициенты
H3PO4-13,72г
Сa(OH)2-32г
для начала надо по таблице менделеева посмотреть молекулярную массу
M(H3PO4)=1*3+31+16*4=98г/моль
М(Ca(OH)2=40+16*2+1*2=74г/моль
теперь надо узнать где недостаток и где избыток,а вот искать двухамещенный фосфат кальция мы будем через недостаток
ищем моль для H3PO4 n=13,72/98=0,14моль
смотрим на коэффициенты
2:3
0,14*1,5=0,21моль
0,21*74=15,54г-находится в избытке
М(Ca3(PO4)2)=40*3+31*2+16*4*2=310г/моль
смотрим на коэффициенты 2:1
m=0,5*310=155г-Сa3(PO4)2
42,55 г 57,45 г
2Me(NO3)2 ⇒ 2MeO + 4NO2↑ + O2↑
(2х+32) г 216 г =(4*(14+16*2)+2*16)⇒
⇒ 4M(NO2)+M(O2)
Cоставляем пропорцию:
42,55/2х+32 = 57,45/216
х=64 ⇒ Cu
ответ: Сu