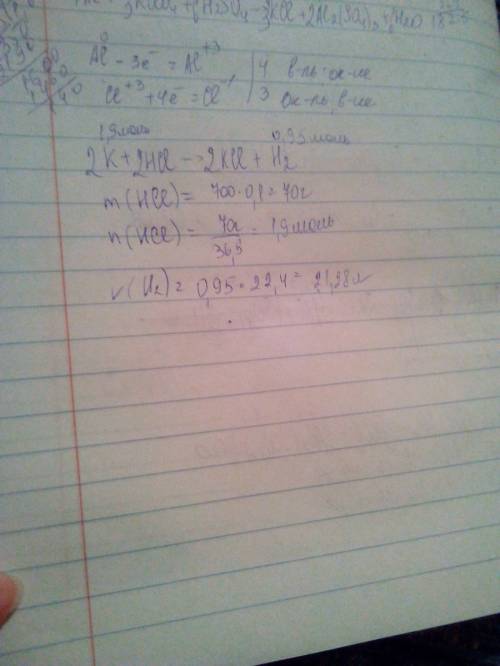
Гру́ппа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.
Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы. Подгруппы также имеют названия по элементу с наименьшим зарядом ядра (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп). Элементы одной подгруппы обладают сходными химическими свойствами.
1 2 3
1) I. С возрастанием порядкового номера элемента в периоде уменьшаются металлические свойства элементов и увеличиваются неметаллические, кроме этого, в периодах (малых) валентность элементов в соединениях с кислородом возрастает от 1 до 7, слева направо. Эти явления объясняются строением атомов:
1) С увеличением порядкового номера в периоде постепенно заполняются электронами внешние энергетические уровни, количество электронов на последнем уровне соответствует номеру группы и высшей валентности в соединениях с ки-слородом.
2) С увеличением порядкового номера в периоде увеличивается заряд ядра, что вызывает увеличение сил притяжения электронов к ядру В результате радиусы атомов уменьшаются, поэтому атомов отдавать электроны (металлические свойства) постепенно ослабевает и последние элементы периодов являются типичными неметаллами.
II. В главных подгруппах с возрастанием порядкового номера увеличиваются металлические свойства элементов и умень-шаются неметаллические. Это объясняется тем, что при одинаковом заряде ядра число заполненных энергетических уровней возрастает, значит увеличивается радиус атома, притяжение
электронов к ядру ослабевает, а металлические свойства отдавать электрон) увеличиваются.
Объяснение:
3)Алюминий-Химический элемент, серебристо-белый лёгкий ковкий металл.
Хлор-Химический элемент, удушливый газ, употр. в технике и в санитарии как обеззараживающее средство и в военном деле при изготовлении отравляющих веществвеществ
5)O (16) e - 8 p-8 n-8
O (17) e-8 p-8 n-9
O (18) e-8 p-8 n-10