1)N2O2 + O2 >
2)2CS2 + 6O2 >2CO2 + 4SO2
3) 2H2O + 4NO2 + O2 > 4HNO3
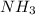 , сближающая его с щелочами, является хорошая "принимать" атомы водорода.
, сближающая его с щелочами, является хорошая "принимать" атомы водорода.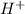 (а точнее
(а точнее 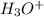 - катион водорода чрезвычайно активен и "липнет" к чему угодно, что может его взять) резко падает. Аммиак "перетягивает одеяло" даже у нейтральной воды (тем самым образуя смесь
- катион водорода чрезвычайно активен и "липнет" к чему угодно, что может его взять) резко падает. Аммиак "перетягивает одеяло" даже у нейтральной воды (тем самым образуя смесь 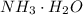 , которая в общем-то может образовать ионы
, которая в общем-то может образовать ионы 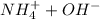 , хотя говорить о гидроксиде аммония не принято - потому что эта "соль" существовать только в растворах).
, хотя говорить о гидроксиде аммония не принято - потому что эта "соль" существовать только в растворах).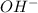 (к слову - растворимость у всех реально существующих солей аммония очень похожа на растворимости солей щелочных металлов, что также указывает на некое сходство), оба этих раствора выступать как акцепторы (т.е. "принимающие", "отнимающие") водород.
(к слову - растворимость у всех реально существующих солей аммония очень похожа на растворимости солей щелочных металлов, что также указывает на некое сходство), оба этих раствора выступать как акцепторы (т.е. "принимающие", "отнимающие") водород.
1)N2O2 такого оксида азота не существует
2) CS2+3O2-->CO2 + 2SO2
3) NO2+H2O+O2-->2HNO3