288 г х л
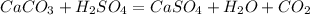
100 г 22,4 л
1. Найдем чистую массу карбоната кальция в мраморе,учитывая,что его содержится 90%(100-10=90):
m(CaCO3)=m(мрамора)*w(CaCO3)=320*0,9=288 г
2. Подставив эту массу в уравнение реакции получим объем углекислого газа:
при взаимодействии 100 карбоната выделяется 22,4 л углекислого газа, а
при -- // -- 288 г__________________х л, откуда
х=288*22,4/100=приблизительно 65 л
288 г х л
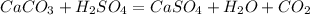
100 г 22,4 л
1. Найдем чистую массу карбоната кальция в мраморе,учитывая,что его содержится 90%(100-10=90):
m(CaCO3)=m(мрамора)*w(CaCO3)=320*0,9=288 г
2. Подставив эту массу в уравнение реакции получим объем углекислого газа:
при взаимодействии 100 карбоната выделяется 22,4 л углекислого газа, а
при -- // -- 288 г__________________х л, откуда
х=288*22,4/100=приблизительно 65 л