Нет.
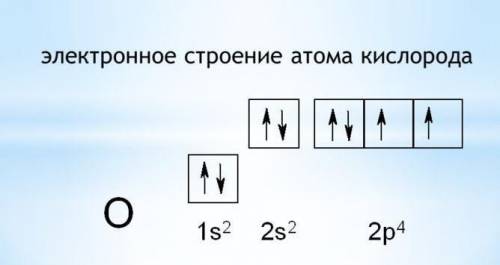
У Кислорода на внешнем уровне(2 уровень), в подуровне р-, два электрона без пары, за счёт них образуются стабильные две связи — валентность II всегда.
У Серы есть ещё и третий уровень, в котором есть s-, p- и d- подуровни. Поэтому у серы больше валентностей. В возбуждённом состоянии сера может проявлять валентность IV и VI кроме II.
Под n на рисунке подразумевается номер уровня.
16S 1s2 2s2 2p6 3s2 3p4 — валентность II, H2S;
16S* 1s2 2s2 2p6 3s2 3p3 3d1 — валентность IV, SO2;
16S** 1s2 2s2 2p6 3s1 3p3 3d2 — валентность VI, Na2SO4
На рисунке представлен внешний электронный уровень у серы в соединениях, указанных в качестве примеров.
У кислорода валентность II ВСЕГДА. Что в простом веществе O2, что в соединении H2O

Объяснение:
По данной сокращенной ионной форме составить уравнения реакций в молекулярной форме: а) Zn2+ + S2−→ ZnS↓ ; б) Fe + Cu2+ → Fe2+ + Cu ; в) CO2 + 2OH− → CO32− + H2O ; г) Cr(OH)3 + OH− → CrO2− + 2 H2O д) NO2− + H+ → HNO2 е) 2 H+ + S2− → H2S
а) Zn2+ + S2−→ ZnS↓ ; ZnCl2 + Na2S = ZnS↓ + 2NaCl
б) Fe + Cu2+ → Fe2+ + Cu ; Fe + CuSO4 = FeSO4 + Cu↓
в) CO2 + 2OH− → CO32− + H2O ; CO2 + 2NaOH = Na2CO3 + H2O
г) Cr(OH)3 + OH− → CrO2− + 2 H2O
Cr(OH)3 + KOH = KCrO2 + 2 H2O
д) NO2− + H+ → HNO2
KNO2 + HCl = HNO2 + KCl
е) 2 H+ + S2− → H2S 2HCl + Na2S = H2S + 2NaCl
1, 112/22,4*17=85г
масдол=85/385=22%
5, 0,4мр/мр+500=0,15
мр=300г
6. м1=2,52г
ню=0,015 моль
ню2=0,011 моль
по недостатку
масса осадка хлорида серебра=0,011*143,51,6г