288 г х л
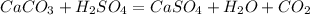
100 г 22,4 л
1. Найдем чистую массу карбоната кальция в мраморе,учитывая,что его содержится 90%(100-10=90):
m(CaCO3)=m(мрамора)*w(CaCO3)=320*0,9=288 г
2. Подставив эту массу в уравнение реакции получим объем углекислого газа:
при взаимодействии 100 карбоната выделяется 22,4 л углекислого газа, а
при -- // -- 288 г__________________х л, откуда
х=288*22,4/100=приблизительно 65 л
3С + 4Al = Al4C3
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
CH4 + 2O2 = CO2 + 2H2O
2NaOH + CO2 = Na2CO3 + H2O
Na2CO3 + CaCl2 = 2NaCl + CaCO3
CaCO3 + 2HCl = CaCl2 + CO2 + H2O