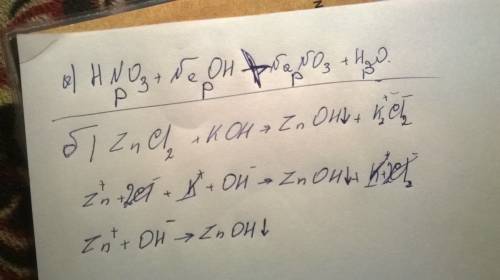
Объяснение:
Решите любые 3 задания
По данным таблицы вычислить дельта Go298 реакции:
2(NH3) + 2,5 (O2) = 2 (NO) + 3 {H2O}.
В условии задачи и в уравнении реакции не указаны состояния веществ, но можно принять, что это реакция каталитического окисления аммиака и все исходные вещества и продукты реакции находятся в газообразном состоянии.
Определить термодинамическую возможность протекания процесса при стандартных условиях. Как повлияет на ход прямой реакции повышение температуры.
Энергию Гиббса химической реакции можно рассчитать как сумму энергий
Гиббса образования продуктов реакции за вычетом энергий Гиббса
образования исходных веществ с учетом стехиометрических коэффициентов
по формуле:
ΔGреакц. = ΣΔG° 298 прод. – ΣΔG°298 исход
где ΔG° 298 –стандартная энергия Гиббса образования веществ.
ΔG° (O2) = 0 кДж/моль
ΔG° (NO) = 87,6 кДж/моль
ΔG°(H2O) = - 228,6 кДж/моль
ΔG°(реакции) = [ 3× (-228,6) + 2× 87,6] - [ 2×(-16,4] = - 477,8 кДж/моль
Отрицательное значение энергии Гиббса указывает на то, что реакция может протекать в стандартных условиях
Если подсчитать изменение энтальпии процесса
ΔН° (NH3) = - 45,9 кДж/моль
ΔН° (O2) = 0 кДж/моль
ΔН° (NO) = 91,3 кДж/моль
ΔН°(H2O) = - 241,8 кДж/моль
ΔН°реакц. = ΣΔН° 298 прод. – ΣΔН°298 исход
ΔН°реакц. = [3× (-241,8) + 2× 91,3] - [ 2× (-45,9) = - 451, 0 кДж/моль
Отрицательное значение изменения энтальпии указывает, то реакция экзотермическая и повышение температуры вызовет сдвиг равновесия процесса в сторону обратной реакции.
3. Определите равновесную концентрацию азота и начальные
аммиака и кислорода в реакции
4(NH3) + 3(O2) ⇔2(N2) + 6 (H2O),
если известно, что равновесные концентрации аммиака 1,22 моль/л, кислорода 2,79 моль/л и воды 7,56 моль/л:
Система находится в равновесии
4. Какими изменениями концентрации паров диоксида серы, температуры, общего давления можно повысить выход продукта в системе
2(SO2) + (O2) ⇔ 2(SO3).
Система находится в равновесии и протекает с уменьшением объема реагирующей системы. Поэтому с увеличением внешнего давления равновесие системы сместится в сторону прямой реакции, а при при понижении внешнего давления в сторону обратной реакции.
ответ мотивируйте.
5. Исходные концентрации оксида азота (II) и хлора в системе
2NO + Cl2 ⇔ 2NOCl
составляют соответственно 0.5 и 0.2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% оксида азота (II).
Раз к моменту наступления равновесия прореагировало 20% оксида азота то это составило 0,1 моль тогда равновесная концентрация конечного продукта [NOCl] = 0,1 моль
А равновесная концентрация [NO] = 0,5-0,1 = 0,4 моль.
А равновесная концентрация хлора [Cl] = 0,2 - 0,05 = 0,15 моль
[NOCl]² ( 0,1)²
К рав = = = 0,417
[NO]²· [Cl] ( 0,4)²· 0,15
Объяснение:
Вычислите массу образовавшегося осадка, если к 55 г AgNO3 прибавить 26 г NaCl.
С шагами
1. Запишем уравнение реакции.
AgNO3 + NaCl = AgCl↓ + NaNO3
2. Рассчитаем молярные массы нитрата серебра и хлорида натрия и хлорида серебра
М(AgNO3 ) = 170 г/моль М(NaCl) = 58,4 г/моль М(AgСl ) = 143,3 г/моль
3. Рассчитаем количество вещества нитрата серебра и хлорида натрия.
n(AgNO3) = 55 г: 170 г/моль = 0,3235 моль
n(NaCl) = 26 г : 58,4 г/моль = 0,4452 моль
В избытке взят хлорид натрия, поэтому дальнейший расчет ведем по количеству нитрата серебра.
Следовательно, по уравнению реакции количество хлорида серебра составит 0,3235 моль
4. Вычислим массу осадка:
m(AgCl) = M×n = 143,3 г/моль ×0,3235 моль = 46,36 г