Получим гидроксид железа (III) Fe(OH)3 взаимодействием растворов хлорида железа (III) FeCl3 и гидроксида калия KOH. Это обычный получения нерастворимых оснований – реакция обмена растворимой соли и щелочи.
FeCl3 + 3KOH = Fe(OH)3 ↓+ 3KCl
Выпадает бурый осадок. Это гидроксид железа (III). Как гидроксид реагирует с кислотами? Добавим раствор соляной кислоты.
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Осадок гидроксида железа растворяется, образуется желтый раствор хлорида железа (III). Реакции обмена с кислотами могут превращать нерастворимые основания в растворимые соли.
Оборудование: колба, пипетка.
Техника безопасности.
Соблюдать правила обращения с растворами кислот и щелочей. Избегать попадания кислот и щелочей на кожу и слизистые оболочки.
Уравнение реакции( один из вариантов):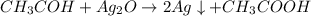
Чтобы расчитать выход продукта, нам нужно узнать сколько теоретически должно было выделиться продукта( "на бумаге").
Воспользуемся известной массой уксусного альдегида и найдём, сколько этого самого альдегида вступило в реакцию:
n( количество вещества) = m( масса) / M( молярная масса) - общая формула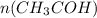 = 4,4 / 44= 0,1 моль
= 4,4 / 44= 0,1 моль
Из уравнения реакции видно, что коэффициент перед уксусным альдегидом равен коэффициенту перед уксусной кислотой, т.е. 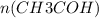 =
= 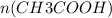 = 0,1 моль
= 0,1 моль
Теперь, пользуясь уже знакомой формулой n( количество вещества) = m( масса) / M( молярная масса), мы можем найти массу ( теоретическую) уксусной кислоты: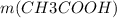 =
= 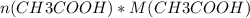 = 0,1 * 60 = 6 г.
= 0,1 * 60 = 6 г.
Выход продукта расчитываем по формуле:
w = m( практ) / m( теор) * 100% = 90%
ответ: выход продукта составил 90%.
масса раствора ровен 200*1,08=216 г
а масса сульфатной кислоты (216*15)/100=32,4 г если ми добавым воды то получется 216+50=266 г раствора. и массовой доля кислоты будет (32,4*100)/266=12,18 г .