200 грамм
Объяснение:
CH ≡ CH + 2Br2 → CHBr2 — CHBr2
v(C2H2) = 0.448 л
n(C2H2) = 0.448 : 22.4 = 0.02 моль
По реакции моли ацетилена и брома относятся как 1 к 2, а по задаче мы выяснили, что 0.02 моль ацетилена вступают в реакцию с X молями брома. Из этого следует, что :
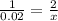
x= 0.04 моль Br2 реагирует с 0.02 молями C2H2
n(Br2) = 0.04 моль
m(Br2) = 0.04 × 160 = 6.4 грамм Br2.
Теперь переходим к раствору
w(р-ра) = 3.2% или 3.2 ÷ 100= 0.032 это массовая доля
m1(Br2) = 6.4 грамм
m(р-ра) = Х
Составляем уравнение:
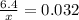
x= 200 грамм
Значит для обесцвечивания ацетилена объемом 0.448 литром, нам понадобилось 200 грамм 3.2% раствора бромной воды
Если будут вопросы, то можете отписать в комментариях.
По правилу Ле Шателье:
для первой реакции
1) при уменьшении температуры химическое равновесие сместится в сторону экзотермической реакции , то есть влево
2) не смещается, так как изменение давления не повлияет на химическое равновесие
3)при увеличении концентрации образования веществ химическое равновесие сместится в сторону исходных веществ, то есть влево
для второй реакции
1)сместится влево, подчиняется такому же правилу(при уменьшении температуры-смещение в сторону экзотермической реакции)
2)сместится влево, так как слева 1 моль CO2, а справа 2 моль CO (при увеличении давления химическое равновесие сместится в сторону меньшего объема)
3)при увеличении концентрации исходных веществ, химическое равновесие сместится в сторону образования веществ(продуктов), то есть вправо
а 2
б 4
в 6
г 7