1) Добавляем в каждую пробирку гидроксид бария. Реакция пойдет лишь в пробирках, содержащих сульфат-ион (мы это определим увидев осадок на дне пробирки). Соответственно сразу мы определяем нитрат аммония, с которым не было реакции.
2) Ba(OH)2 + H2SO4 + BaSO4(осадок) + H2O
Ba(OH)2 + (NH4)2SO4 = BaSO4(осадок) + 2NH3 + 2H2O
В общем-то, в последней реакции мы почувствуем запах выделяющегося аммиака и тем самым сразу поймем, где сульфат аммония.
Конечно, можно начать извращаться, и скажем подлить некое кол-во серной кислоты везде, а потом швырнуть туда кусок. какого-нибудь малоактивного металла, чтобы пошла сложная окис.-восстан. реакция в той пробирке, где была серная кислота, но все это лишне.
Итак, мы одним веществом определили все остальные.
1.
А. 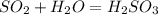
Б. 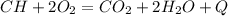
В. 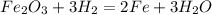
1.
А. 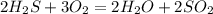
Б. 
В. 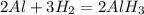
2.
mH2O = 35г
mсоли = 10г
mраствора = mсоли+mводы = 35г+10г = 45г
w = mсоли/mр-ра = 10г/45г*100% = 22,2%
2.
mр-ра = 300г
wсоли = 0,05
mсоли = w*mр-ра = 0,05*300г = 15г
mводы = mр-ра - mсоли = 300-15 = 285г
3.
C -> XH4 -> CO2 -> H2CO3
1. C + 2H2 = CH4 - соединение, обр. метан
2. CH4 + 2O2 = CO2 + 2H2O - разложение, с образованием углекислого газа и воды.
3. CO2 + H2O = H2CO3 - соединение, обр. уголная кислота
3.
Al -> Al2O3 -> Al -> Al(OH)3
1. 4Al + 3O2 = 2Al2O3 - соединение, обр. оксид алюминия.
2. 2Al2O3 --эл. ток--> 4Al + 3O2 - разложение, обр. алюминий и кислород
3. 2Al + 6H2O = 2Al(OH)3 + 3H2 - замещение, обр. гидроксид алюминия и водород.
m'(p-pa NaOH) = V(p-pa NaOH)*ρ(p-pa NaOH) = 200 мл*1,11 г/мл=222 г
2) Вычисляем массу NaOH в растворе:
m'(NaOH) = m(p-pa NaOH)*ω(NaOH) = 222 г*0,1 = 22,2 г
3) Составляем уравнение реакции:
0.115 г х г у г
2Na+2H2O = 2NaOH + H2↑
46 г 80 г 2 г
х=m"(NaOH) = 0,115*80/46=0,2 г
у=m(H2) = 0,115*2/46 = 0,005 г
4) Таким образом масса нового раствора будет равна:
m(p-pa NaOH) = m'(p-pa NaOH)+m(Na)-m(H2)
m(p-pa NaOH) = 222 г+0,115 г-0,005 г = 222,11 г
5) Находим массу NaOH
m(NaOH) = m'(NaOH)+m"(NaOH)
m(NaOH) = 22,2 г + 0,2 г = 22,4 г
6) Находим массовую долю NaOH в новом растворе:
ω(NaOH) = m(NaOH)/m(p-pa NaOH)
ω(NaOH) = 22.4 г/222,11 г = 0,1009 или 10,09%
ответ: 10,09%