Привет! Сейчас решим
Оксиды щелочных металлов имеют общую формулу Me2O. Составим уравнения реакции
Me2O + 2HCl = 2MeCl + H2O
Рассчитаем массу кислоты.
m(р-ра) = 278,9*1,047 = 292 г
m(HCl) = 292*0,1 = 29,2 г
Как видно из уравнения реакции, 1 моль оксида реагирует с двумя моль к-ты. Рассчитаем её количество
n(HCl) = 29,2:36,5 = 0,8 моль. Значит, n(Me2O) = 0,4 моль
m(MeO2) = 24,8 (0,4 моль). Отсюда следует, что
M(Me2O) = 24,8:0,4 = 62 г/моль. Два атома металла весят 62-16 = 46. Следовательно, M(Me) = 46:2 = 23 г/моль. Это Na - натрий
Готово! Есть вопросы? Напиши и я отвечу

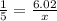
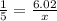
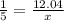
2A+B=C+В
1. На образование 1 моля вещества С расходуются 2 моля вещества А (по уравнению)
2. На образование 0,004 моль вещества С расходуются X моль вещества А...
3. Тогда имеем => 1 моль С 2 моль А
0,004 моль С --X моль А...
Отсюда X=0.004*2/1=0.008 моль
Тогда исходная концентрация вещества А= 0,008+0,03=0,038 моль/л