а)серная кислота и хлорид бария;
H2SO4 + BaCl2 = BaSO4 + 2HCl
2H(+) + SO4(2-) + Ba(2+) + 2Cl(-) = BaSO4 + 2H(+) + 2Cl(-)
SO4(2-) + Ba(2+)= BaSO4
б)сульфат натрия и нитрат бария
Na2SO4 + Ba(NO3)2 = BaSO4 + 2NaNO3
2Na(+) + SO4(2-) + Ba(2+) + 2NO3(-) = BaSO4 + 2Na(+) + 2NO3(-)
SO4(2-) + Ba(2+)= BaSO4
г)хлороводородная кислота и гидроксид натрия;
HCl + NaOH = NaCl + H2O
H(+) +Cl(-)+ Na(+) + OH(-) = Na(+) + Cl(-)+H2O
H(+) + OH(-) =H2O
д)серная кислота и гидроксид калия
H2SO4 +2KOH = K2SO4 + 2H2O
2H(+) + SO4(2-) +2K(+) + 2OH(-) =2K(+) +SO4(2-) +2H2O
H(+) + OH(-) =H2O
200 л 250 л х л
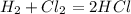
1 объем 1 объем 2 объем
1. Согласно уравнения и закона объемных отношений газообразных веществ,видим,что на 1 объем(1 л или 1 м в кубе) водорода необходимо 1 объем хлора,значит для полного взаимодействия 200 л водорода пойдет 200 л хлора.Т.е. в остатке останется хлор объемом:250-200 = 50 л.
2. Найдем объем хлороводорода,который образуется в результате реакции:
при взаимодействии 1 объема водорода образуется 2 объема хлороводорода, а
при -- // -- 200 л_______________________х л, откуда
х=200*2/1=400 л
m(газа) = 1,5 г
m(CO₂) = 4,4 г
m(H₂O) = 2,7 г
ρ(газа) = 1,34 г/л
V(газа) = 10 л
Найти:
Формула газа - ?
V(O₂) - ?
Решение.
Находим количество углерода и водорода, входящих в состав газа:
n(C)=n(CO₂) = m(CO₂)/M(CO₂) = 4,4 г/44 г/моль = 0,1 моль
n(H) = 2n(H₂O) = 2*m(H₂O)/M(H₂O) = 2*2,7 г/18 г/моль=0,3 моль
Находим соотношение атомов и находим простейшую формулу газа
n(C):n(H) = 0,1:0,3 =1:3, следовательно, простейшая формула СН₃
Находим молярные массы газа по простейшей формуле и плотности:
M(CH₃) = 15 г/моль
М(газа) = Vm*ρ(газа) = 22,4 л/моль*1,34 г/л = 30 г/моль
Сравнивая молярные массы, необходимо индексы в простейшей формуле увеличить вдвое (30 г/моль/15 г/моль=2), следовательно, искомая или истинная формула газа С₂Н₆ - этан
2С₂Н₆ + 7О₂ = 4СО₂ + 6Н₂О
Из уравнения реакции следует:
V(C₂H₆):V(O₂) = 2:7
Исходя из условия:
2:7 = 10:х
х=35 л
ответ: Формула С₂Н₆ - этан; для сжигания 10 л этана необходимо 35 л кислорода