Дано:
а) ω(Cu) = 47,4%
ω(Cl) = 52,6%
б) ω(Fe) = 34,5%
ω(Cl) = 65,5%
--------------------------------
Найти:
а) формулу соли - ?
б) формулу соли - ?
а) Запишем формулу соли 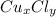
По условии дано, что в 100 единиц массы вещества содержится 47,4% меди и 52,6% хлора. Находим число атомов каждого элемента в 100 единицах вещества, делим их числа на относительные атомные массы:
Пусть m(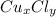 ) = 100 гр, тогда:
) = 100 гр, тогда:
m(Cu) = ω(Cu)×m(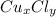 )/100% = 47,4% × 100 гр/100% = 0,474 × 100 гр = 47,4 гр
)/100% = 47,4% × 100 гр/100% = 0,474 × 100 гр = 47,4 гр
m(Cl) = ω(Cl)×m(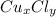 )/100% = 52,6% × 100 гр/100% = 0,526 × 100 гр = 52,6 гр
)/100% = 52,6% × 100 гр/100% = 0,526 × 100 гр = 52,6 гр
M(Cu) = 64 гр/моль M(Cl) = 35,5 гр/моль
x = m(Cu)/M(Cu) = 47,4/64 ≈ 0,74 - атомов меди (Cu)
y = m(Cl)/M(Cl) = 52,6/35,5 ≈ 1,48 - атомов хлора (Cl)
Определим соотношение чисел атомов в формуле вещества:
x : y = 0,74 : 1,48 = 1 : 2
Следовательно мы получаем формулу соли - CuCl₂.
б) Запишем формулу соли 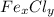
По условии дано, что в 100 единиц массы вещества содержится 34,5% железа и 65,5% хлора. Находим число атомов каждого элемента в 100 единицах вещества, делим их числа на относительные атомные массы:
Пусть m(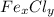 ) = 100 гр, тогда:
) = 100 гр, тогда:
m(Fe) = ω(Fe)×m(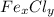 )/100% = 34,5% × 100 гр/100% = 0,345 × 100 гр = 34,5 гр
)/100% = 34,5% × 100 гр/100% = 0,345 × 100 гр = 34,5 гр
m(Cl) = ω(Cl)×m(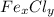 )/100% = 65,5% × 100 гр/100% = 0,655 × 100 гр = 65,5 гр
)/100% = 65,5% × 100 гр/100% = 0,655 × 100 гр = 65,5 гр
M(Fe) = 56 гр/моль M(Cl) = 35,5 гр/моль
x = m(Fe)/M(Fe) = 34,5/56 ≈ 0,62 - атомов меди (Fe)
y = m(Cl)/M(Cl) = 65,5/35,5 ≈ 1,85 - атомов хлора (Cl)
Определим соотношение чисел атомов в формуле вещества:
x : y = 0,62 : 1,85 ≈ 1 : 3
Следовательно мы получаем формулу соли - FeCl₃.
ответ: а) CuCl₂ ; б) FeCl₃
Дано:
m(Ca(OH)₂ = 3,7 гр
m(Na₂CO₃) = 1,06 гр
Найти:
Жо - ?
1) Если при добавлении в воду извести Ca(OH)₂ снижается карбонатная жесткость воды, запишем уравнение:
Ca(HCO₃)₂(р-р) + Ca(OH)₂(р-р) → 2CaCO₃↓(к) + 2H₂O(ж) (1)
2) Если при добавлении в воду соды Na₂CO₃ снижается некарбонатная жесткость воды, запишем его уравнение и их в ионных формах:
Na₂CO₃ + H₂O ⇄ NaHCO₃ + NaOH - молекулярное уравнение
2Na⁺ + CO₃²⁻ + H⁺OH⁻ ⇄ Na⁺ + HCO₃⁻ + Na⁺ + OH⁻ - полное ионное уравнение
CO₃²⁻ + H⁺OH⁻ ⇄ HCO₃⁻ + OH⁻ - сокращенное ионное уравнение
по аниону
Где в получение уравнение OH⁻ - это щелочная среда (pH>7).
Дальше в OH⁻ при получение с Na₂CO₃ в воде, мы добавим двухвалентный металл. В жесткость исходной воды используются двухвалентный металл - это кальция и магнии, в меньшей степени железа. Мы в первой реакции была кальция, значит мы добавим в OH⁻ с магнием, то мы получим гидроксид магния:
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓ (2)
3) По уравнению (1) находим массу Ca(HCO₃)₂:
M(Ca(OH)₂) = 40+(16+1)×2 = 40+17×2 = 40+34 = 74 гр/моль
n(Ca(OH)₂) = m(Ca(OH)₂)/M(Ca(OH)₂) = 3,7 гр/74 гр/моль = 0,05 моль
n(Ca(HCO₃)₂) = n(Ca(OH)₂) = 0,05 моль
M(Ca(HCO₃)₂) = 40+(1+12+16×3)×2 = 40+(1+12+48)×2 = 40+61×2 = 40+122 = 162 гр/моль
m(Ca(HCO₃)₂) = n(Ca(HCO₃)₂)×M(Ca(HCO₃)₂) = 0,05 моль × 162 гр/моль = 8,1 гр
4) По уравнению (2) находим массу Mg(OH)₂:
M(Na₂CO₃) = 23×2+12+16×3 = 46+12+48 = 106 гр/моль
n(Na₂CO₃) = m(Na₂CO₃)/M(Na₂CO₃) = 1,06 гр/106 гр/моль = 0,01 моль
n(Mg(OH)₂) = n(Na₂CO₃) = 0,01 моль
M(Mg(OH)₂) = 24+(16+1)×2 = 24+17×2 = 24+34 = 58 гр/моль
m(Mg(OH)₂) = n(Mg(OH)₂)×M(Mg(OH)₂) = 0,01 моль × 58 гр/моль = 0,58 гр
5) Общую жесткость рассчитываем по формуле:
Жо = m(Ca(HCO₃)₂)/Mэкв(Ca(HCO₃)₂) + m(Mg(OH)₂)/Mэкв(Mg(OH)₂) (3)
6) Сначала найдем Mэкв(Ca(HCO₃)₂) и Mэкв(Mg(OH)₂):
Mэкв(Ca(HCO₃)₂) = M(Ca(HCO₃)₂) × fэкв = 162 гр/моль × 1/2 = 81 гр/моль
Mэкв(Mg(OH)₂) = M(Mg(OH)₂) × fэкв = 58 гр/моль × 1/2 = 29 гр/моль
7) Подставив числовые значения в формулу (3), получаем:
Жо = 8,1/81 × 0,58/29 = 0,1 + 0,02 = 0,12 ммоль экв/л.
ответ: Жо = 0,12 ммоль экв/л.
2К+CuCI2+2H2O→2KCI+Cu(OH)2+H2
Последовательность протекании:
2K+2H2O→2KOH+H2
CuCI2+2KOH→Cu(OH)2+2KCI