Задача №1
Дано:
m(Zn)=13 г
-----
Найти:
m(соли) - ?
Решение
Реакция: 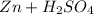 ⇒
⇒ 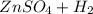 ↑
↑
ν(Zn) = 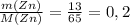 моль (m - масса в (г) [граммы], M - молярная масса, берется из таблицы Менделеева, измеряется в г/моль [грамм поделить на моль] - грамм и грамм сокращаются, остается моль)
моль (m - масса в (г) [граммы], M - молярная масса, берется из таблицы Менделеева, измеряется в г/моль [грамм поделить на моль] - грамм и грамм сокращаются, остается моль)
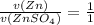 - по уравнению химической реакции (коэффициенты перед веществами в реакции - 1)
- по уравнению химической реакции (коэффициенты перед веществами в реакции - 1)
Тогда:
ν(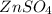 ) = ν(Zn) = 0,2 моль
) = ν(Zn) = 0,2 моль
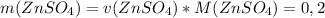 моль
моль  г/моль = 32,2 г
г/моль = 32,2 г
*молярная масса сульфата цинка была посчитана из таблицы Менделеева: M(Zn) + M(S) + 4*M(O) = 65 г/моль + 32 г/моль + 4*16 г/моль = 161 г/моль
ответ: 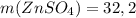 г
г
Задача №2
Дано:
m(HCl) = 127,3 г
-----
Найти:
m(газа) - ?
Решение
Реакция: 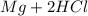 ⇒
⇒  ↑
↑
ν(HCl) = 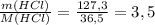 моль
моль
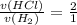 - по уравнению химической реакции (коэффициент перед HCl - 2, перед водородом - 1)
- по уравнению химической реакции (коэффициент перед HCl - 2, перед водородом - 1)
Тогда:
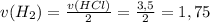 моль
моль
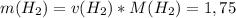 моль
моль 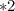 г/моль = 3,5 г
г/моль = 3,5 г
ответ: 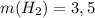 г.
г.
2. ZnSO4
W(Zn) - ?
W(S) - ?
W(O) - ?
W(Zn) = 65 / (65+32+16*4) = 65 / 161 = 0.403 = 40.3 %
W(S) = 32 / 161 = 0.198 = 19.8%
W(O) = 100 - 40.3 - 19.8 = 39.9 %
(если надо округлить до целых то будет: w(Zn) = 40%, W(S) = 20 %, W(O) = 40%)
3. AgxNyOz - ?
X:Y:Z = 63.53 / 108 : 8.23 / 14 : 28.24/16 = 0.58 : 0.58 : 1.76 = 1:1:2
AgNO2 - выходит, но что то в задании не верно т.к нитрат это NO3, а вышел нитрИт NO2.
4.
W(H) = 1/41 = 0.024 = 2.4 %
W(S) = 16 / 41 = 0.39 = 39%
W(O) = 100 - 39 - 2.4 = 58.6 %
HxSyOz - ?
X:Y:Z = 2.4 / 1 : 39 / 32 / 58.6 : 16 = 2.4 : 1.2 : 3.66 = 2:1:4
H2SO4 - серная кислота(разбавленная)
x=16+0,2x
x=20 г.
ответ: C.