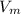 * n = 22,4 м³/кмоль * 3,5 кмоль = 78,4 м³
* n = 22,4 м³/кмоль * 3,5 кмоль = 78,4 м³1)Находим массу чистого вещества(без примесей)
500 000 г-100%
хг -30%
х=500 000 * 30%/100%= 150 000 г (это масса примесей)
m(чистого в-ва)=500 000 - 150 000= 350 000 г
2) Уравнение реакции:
350 000 г х л
CaCO3 + 2HCl> CaCl2 + CO2(стрелка вверх) +H2O
M=100г/моль Vm= 22,4л/моль
m=100 г V=22,4л
Пропорция: 350 000/100=x/22,4
=> x=350 000*22,4/100= 78 400 л
3)Рассчитаем кол-во вещества газа:
Формула: v=V/Vm
v(CO2)=78 400 л/22,4 л/моль= 3500 молей.
Овет:78 400 л; 3 500 молей.
SO₂ + H₂O= H₂SO₃
H₂SO₃ + Ba(OH)₂ = BaSO₃↓ + 2H₂O
Сульфит бария нерастворимое вещество, что бы получить сероводород необходимо в цепочку добавить другие вещества,
ВaSO₃ + 2HCI =BaCI₂ + SO₂ + H₂O
SO₂ + 2CO = 2CO₂ + S
S+ H₂=H₂S
H₂S + 2NaOH=Na₂S + 2H₂O
Цепочка превращений будет выглядеть так:
S→SO₂→H₂SO₃→BaSO₃→SO₂ →S →H₂S →Na₂S