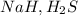
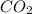
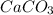
1) 2AlCl3 + 3Ca = 3CaCl2 + 2Al
Al(+3) +3e = Al(0) 2 ок-ль, в-ие
Ca(0) -2e = Ca(+2) 3 в-ль, ок-ие
3)2 Al +3 Cl2 = 2AlCl3
2AlCL3 + 3Mg =3 MgCl2 + 2Al
2Al +3 S = Al2S3
Al2S3 + 6NaOH= 2Al(OH)3 + 3Na2S
2Al(OH)3 = Al2O3 + 3H2O
2Al2O3 =4 Al +3 O2
4-1) 2Al + 6H2O = 2Al(OH)3
Al(OH)3 + 3HCl = AlCl3 + 3H2O
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
Al(OH)3+ NaOH = Na [Al(OH)4]
2) 4Al + 3O2 = 2Al2O3
Al2O3 +2NaOH + 3H2O = 2Na[Al(OH)4]
Na[Al(OH)4] + HCl = Al(OH)3 + NaCl + H2O
2Al(OH)3 = Al2O3 +3 H2O
2Al2O3 =4 Al +3 O2
2Fe₂S₃⁻² + 9O₂⁰ = 2Fe₂O₃⁻² + 6S⁺⁴O₂
S⁻² - 6e⁻ = S⁺⁴ | 1 - восстановитель, процесс окисления
O₂⁰ + 2e⁻ = 2O⁻² | 3 - окислитель, процесс восстановления
2) O₂(г)+2NO(г)=2NO₂(г)+Q
Реакция соединения, экзотермическая, окислительно-восстановительная
3) 2NO(г)+O₂(г)=2NO₂(г)+Q
По УХР видим, что реакция экзотермическая, идет с уменьшением объема, согласно принципа Ле Шателье повышение давления в данном случае приведет к смещению равновесия в сторону образования продукта реакции (вправо), снижение температуры также приведет к смещению равновесия в сторону образования продукта реакции (вправо), повышение концентрации одного из реагентов или снижение концентрации продукта реакции также приведет к смещению равновесия в сторону образования продукта реакции (вправо).
4. 4NH3+5O2=4NO+6H2O
До изменения концентрации скорость реакции выражалась уравнением:
v₁= k[NH₃]⁴[O₂]⁵
После уменьшения концентрации NH₃ в 2 раза
v₂ = k(¹/₂[NH₃])⁴[O₂]⁵ = 0.0625k[NH₃]⁴[O₂]⁵
v₁/v₂ = ¹/0.0625 = 16
Скорость реакции уменьшится в 16 раз.
5.
(60-30) = 30 30/10=3
2³ = 8
Скорость реакции уменьшится в 8 раз
6.
М(С₂Н₄) = 28 г/моль
n(С₂Н₄) = 112 г/28 г/моль = 4 моль
C₂H₄+3O₂=2CO₂+2H₂O
Q = Q'/n = 5292 кДж/4 моль = 1323 кДж/моль
ответ: C₂H₄+3O₂=2CO₂+2H₂O + 1323 кДж