1) Массу растворенного вещества в растворе рассчитывают по формуле:
m(NaOH) = ω * m(p-p)
где: m(p-p) - масса раствора в граммах
ω - массовая доля растворенного вещества, выраженная в долях единицы.
2) Имеется раствор №1, массовая доля которого ω₁ = 0,45 (45%), так как масса этого раствора неизвестна, обозначим её через m₁ г.
Также имеется раствор №2, массовая доля которого ω₂ = 0,12 (20%) и масса его равна m₂(p-p) = 350 г
После сливания растворов получается новый раствор №3, масса нового раствора равна m₃(p-p) = (m₁ + m₂) = (m₁ +350) г а его массовая доля равна 0,2 (или 20%)
3) Так как масса растворенного вещества в растворе №3 равна сумме масс растворенного вещества растворов №1 и №2, то запишем:
0,45*m₁ + 0,12*350 = 0,2*(m₁ +350)
0,45*m₁ + 42 = 0,2m₁ + 70
0,25m₁ = 28
m₁ = 112
ответ: 112 г
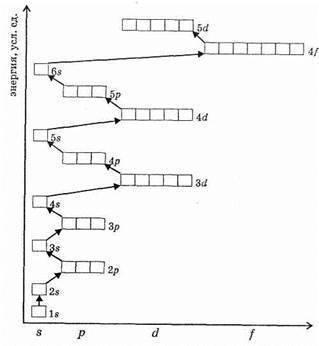
Порядок заполнения электронами атомных орбиталей определяется:1.Принципом наименьшей энергии(картинка 1).
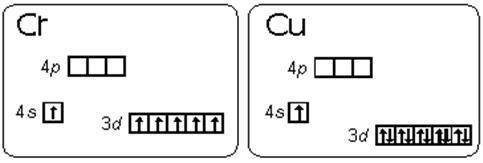
2. Состояние атома с полностью или наполовину заполненным подуровнем (т. е. когда на каждой орбитали имеется по одному неспаренному электрону) является более устойчивым.Этим объясняется «провал электрона. (картинка 2)
Атом хрома имеет электронную конфигурацию не 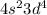 , a
, a 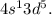 Это является примером того, как стабилизация состояний с параллельными спинами электронов преобладает над незначительной разницей энергетических состояний подуровней
Это является примером того, как стабилизация состояний с параллельными спинами электронов преобладает над незначительной разницей энергетических состояний подуровней 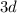 и
и 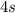 (правила Гунда), то есть энергетически выгодными состояниями для d-подуровня являются
(правила Гунда), то есть энергетически выгодными состояниями для d-подуровня являются 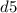 и
и 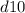 .
.
Подобный переход одного электрона с 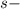 подуровня на
подуровня на 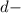 подуровень происходит еще у 8 элементов: Cu, Nb, Mo, Ru, Ag, Pt, Au. У атома Pd происходит переход двух
подуровень происходит еще у 8 элементов: Cu, Nb, Mo, Ru, Ag, Pt, Au. У атома Pd происходит переход двух 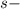 электронов на
электронов на 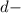 подуровень: Pd:
подуровень: Pd: 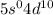 .
.
2 Одна молекула CO2
3 Молекула состоит из одного атома углерода и двух атомов кислорода
4 Относительная атомная масса равна 28
5 Один г либо г/моль СO2
6 Молекулярная масса равна 44г/моль