1. Спирти мають функціональну гідроксильну групу(-ОН), тільки одноатомні мають у своїй будові лише одну групу,а багатоатомні-дві або більше.
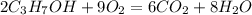
2.а) 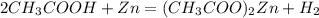 -ацетат цинка и водород(реакция замещения)
-ацетат цинка и водород(реакция замещения)
б) 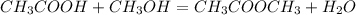 -метиловый эфир уксусной кислоты и вода(реакция обмена)
-метиловый эфир уксусной кислоты и вода(реакция обмена)
в) 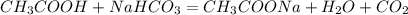 -ацетат натрия,вода и углекислый газ(реакция обмена)
-ацетат натрия,вода и углекислый газ(реакция обмена)
3. До складу твердих жирыв входять залишки насичених вищих карбонових кислот(стеаринової або пальмітинової),а до рідких-залишки ненасичених вищих карбонових кислот(олеїнової).Тверді жири - це тваринні жири(крім риб'ячого),а рідкі - рослинні(крім пальмового масла).Жири в живих організмах виконують енергетичну роль(при окисненні жирів вивільняється майже в два рази більше енергії,ніж при окисненні такої ж кількості вуглеводів або білків),будівельну(входять до складу біологічних мембран),захисну(жир підшкірної клітковини захищає від механічних ушкоджень внутрішні органи)
4. Сахароза - це типовий дисахарид,який складається із залишків глюкози і фруктози.Тверда кристалічна речовина,добре розчинна у воді,трохи солодша на смак від глюкози.Поширена у природі у цукровому буряці та цукровій тростині,з яких і видобувають цукор(сахарозу).В присутності концентрованної сульфатної кислоті гідролізує(тобто взаємодіє з водою),в результаті утворюються глюкоза і фруктоза:
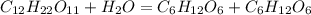
При повному окисненні утворюються вода і вуглекислій газ:
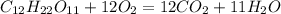
Все многообразие белков построено из α-аминокислот. Общее число α-
аминокислот, входящих в их состав, близко к 70. Среди них выделяется груп-
па из 20 наиболее важных α-аминокислот, постоянно встречающихся во всех
белках. Аминокислоты — кристаллические вещества, растворимые в воде. В
твердом состоянии α-аминокислоты существуют в виде биполярного иона. α-
Аминокислоты — гетерофункциональные соединения, содержащие карбок-
сильную группу и аминогруппу у одного и того же α-углеродного атома.
Принцип построения α-аминокислот, т. е. нахождения у одного и того же
атома углерода двух различных функциональных групп, радикала и атома во-
дорода, предопределяет хиральность (асимметричность) α-углеродного ато-
ма (исключение составляет глицин). Почти все природные α-аминокислоты
принадлежат к L-ряду (расположение аминогруппы в проекционной формуле
Фишера слева).
Использование для построения белков живых организмов только энантио-
меров L-ряда имеет важнейшее значение для формирования пространственной
структуры белков и проявления ими биологической активности.
α-Аминокислоты являются амфотерными соединениями, что обусловле-
но наличием в их молекулах функциональных групп кислотного и основно-
го характера. Поэтому α-аминокислоты образуют соли как со щелочами, так
и с кислотами:
В водном растворе α-аминокислоты существуют в виде равновесной смеси
биполярного иона, катионной и анионной форм молекул. Положение равнове-
сия зависит от рН среды:
Ионное строение придает некоторые особенности α-аминокислотам: высо-
кую температуру плавления (выше 200 °С), нелетучесть, растворимость в
воде, что является важным фактором в обеспечении их биологического
функциони рования, их всасываемость, транспорт в организме и т. п.
Положение равновесия, т. е. соотношение разных форм α-аминокислоты в
водном растворе при определенных значениях рН, существенно зависит от
строения радикала, главным образом от наличия в нем ионогенных групп,
играющих роль дополнительных кислотных или основных групп. Общим для
всех α-аминокислот является преобладание катионных форм в сильнокис-
лых (рН 1–2) и анионных — в сильнощелочных (рН 13–14) средах.
Значение рН, при котором концентрация биполярных ионов максимальна,
называется изоэлектрической точкой (ИЭТ, pI). Значение pI определяется по
уравнению: pI = ½ (pK1 + рK2). Величина рК (отрицательный десятичный
логарифм константы диссоциации) характеризует кислотные и основныесвой-ства карбоксильной и аминогрупп.