1. а) 2-метилпентанол - 3
б) бутандиол - 1,2
в) 2,4 - метил, 3- этилпентанол - 2
2. а) CH₃-CH₂-OH + Na = CH₃-CH₂-ONa + H₂
в) CH₃-CH₂-OH + HCl = CH₃-CH₂-Cl + H₂O
д) CH₃-CH₂-OH + NaOH = CH₃-CH₂-ONa + H₂O
3.Область применения глицерина разнообразна: пищевая промышленность, табачное производство, электронные сигареты, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника.
4 и 5 в прикреплённых файлах


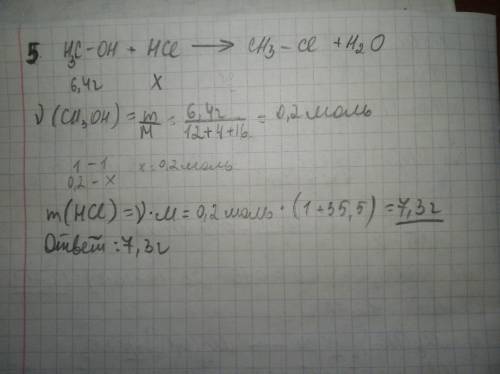
Объяснение:
Вычислить объем газа , выделившегося при взаимодействии 180 г. мела , содержащего 85 % карбоната кальция со 120 г.соляной кислоты при 70 % выходе.
Масса мела 180 г, массовая доля карбоната кальция 85%.
Найдем массу карбоната кальция
m(CaCO3) = 180 г × 0,85 = 153 г.
Молярная масса карбоната кальция 100 г/моль.
Вычислим количество вещества карбоната кальция
n(CaCO3) = 153 г : 100 г/моль = 1,53 моль
Запишем уравнение взаимодействия карбоната кальция с соляной кислотой:
1,53 моль 3,29 моль 1,53 моль
СaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Молярная масса соляной кислоты 120 г определим какому количеству вещества это соответствует
120 г : 36,5 г/моль = 3,29 моль
Из уравнения реакции видно, что кислота взята в избытке и дальнейший расчет ведем по количеству вещества карбоната кальция. Таким образом, углекислого газа выделится 1,53 моль при 100% выходе.
Но по условию задачи выход углекислого газа 70%. Тогда объем СО2 составит:
V CO2 = 22,4 л/моль ×1,53 моль х 0,70 = 24 л.
Поскольку элемент X трехвалентный, формула его хлорида XCl₃.
Будем считать, что хлорид образуется в реакции с соляной кислотой.
Возможно, на самом деле элемент Х не вступает в эту реакцию, но для удобства расчетов предположим, что это так.
X + 3HCl = XCl₃ + 3/2 H₂
1,5 г. 3,63 г.
M(X) = A г/моль, M(XCl₃) = A + 3*35,45 г/моль
Из A г. X получается A + 3*35,45 г. XCl₃
Из 1,5 г. X получается 3,63 г. XCl₃
Из получившейся пропорции следует:
A * 3.63 = 1.5 * (A + 3*35,45 )
3.63 * A = 1.5 * A + 159.525
2.13 * A = 159.525
A = 74.89 г/моль
Ближайший по массе элемент - мышьяк As (A=74.922)
Тогда А = 75 г/моль
Мышьяк действительно проявляет степень окисления +3 и образует соединения с галогенами, в частности с хлором AsCl₃
Мышьяк реагирует со смесью концентрированных соляной и азотной кислот с образованием AsCl₃. Водород в этом случае не выделяется. А восстанавливается азот азотной кислоты до NO.
Тем не менее, фактор эквивалентности мышьяка f равен 1/3, поскольку при окислении мышьяка он теряет 3 электрона.
Поэтому молярная масса эквивалента равна A*f = A/3 = 75 / 3 = 25 г/моль
Проверка
2 As + 3 Cl₂ = 2 AsCl₃
2*74.922 г/моль 2*(74,922 + 3*35,453) г/моль
1,5 г. 3,63 г.
Сколько получится хлорида мышьяка, исходя из его молекулярной массы и массы и атомной массы мышьяка.
х = 1,5 * 2*(74,922 + 3*35,453) / 2*74.922 = 3,629 ≈ 3,63 г.
Расчетное значение практически совпадает с условием задачи