Объяснение:
1. З нерозчинним у воді 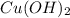 блакитного кольору утворює комплексну сполуку яскраво-блакитного кольору(прикладаю реакцію)
блакитного кольору утворює комплексну сполуку яскраво-блакитного кольору(прикладаю реакцію)
Висновок: для якісного визначення глюкози використовують важкі метали.
2. Етаналь можна визначити за до реакції "срібного дзеркала":
СН3-СНО + 2[Ag(NH3)2OH = CH3COOH + 2Ag(осад) + 4NH3 + H2O
на стінках пробірки утворюється тонкий шар срібла.
Висновок: для виявлення альдегідів можна узяти аміачний розчин аргентум(І) оксиду
Сахарозу можна виявити за реакцією:
С12H22O11 + Ca(OH)2 = C12H22O11*CaO + H2O
Cпостереження: утворення безбарвного розчину кальцій сахариту
Висновок: для виявлення сахарози необхідно узяти кальцій гідроксид
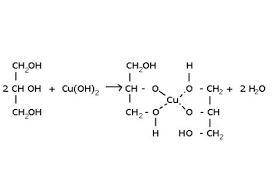
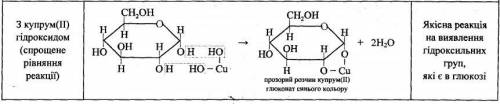
3. Для виявлення гідроксильної групи:
прикладаю фото
утворюється прозорий розчин купрум(ІІ) глюконату синього кольору
Для виявлення альдегідної групи:
CH2OH-(CHOH)4--CHO + Cu(OH)2 =(нагрівання) CH2OH-(CHOH)4-COOH + CuOH + H2O
За подальшого нагрівання утворюється осад цегляно-червоного кольору:
2CuOH = Cu2O(ocaд) + Н2О
блакитний купрум (ІІ) гідроксид розчиниться, а замість нього утвориться оранжевий осад купрум (І) гідроксиду, який за подальшого нагрівання набуде цегляно-червоного кольору.
Висновок: Щоб виявити глюкозу нам необхіден такий реактив як купрум (ІІ) гідроксид. Зазначимо те, що для виявлення альдегідної групи треба здійснити нагрівання
Объяснение:
При нагревании до 180° С в умеренном количестве кислорода образуется оксид натрия:4Na + O2 = 2Na2O
2. Натрий горит на воздухе с образованием пероксида натрия:
2Na + O2 = Na2O2
Натрий хранят под слоем керосина.
3. Расплавленный натрий в хлоре сгорает с ослепительной вспышкой (можно говорить проще — реагирует с хлором при нагревании), на стенках сосуда образуется белый налет хлорида натрия:
2Na + Cl2 = 2NaCl
4. Натрий может взрываться при растирании с порошком серы (образуется сульфид натрия):
2Na + S = Na2S
5. Натрий при нагревании восстанавливает водород, образуется гидрид натрия:
2Na + H2 = 2NaH
V(NO2)=0,112 л
m(ост.)=2,065 г
V(H2)=1,344 л
w-?
Решение:
При введении смесь в концентрированную азотную кислоту, прореагирует только медь. Алюминий в конц. азотке пассивируется.
А золото просто не реагирует.
При введении смесь в хлороводород будет реагировать только алюминий, т.к. медь и золото в ряду активности стоят за водородом.
1) Cu+4HNO3(к)=Cu(NO3)2+2NO2↑+2H2O
в осадке останется смесь Al и Au=2,065 г
2) 2Al+6HCl=2AlCl3+3H2↑ объем водорода=1,344 л
Начнем с меди:
n(NO2)=V(NO2)/Vm=0,112(л)/22,4(л/моль)=0,005 моль
Vm=22,4 л/моль - молярный объем
Из реакции (1) следует:
n(Cu)/n(NO2)=1/2 ⇒ n(Cu)=0,0025 моль
m(Cu)=64(г/моль)*0,0025(моль)=0,16 (г)
Чтобы найти массу общей смеси, нужно к массе остатка(из 1-ой р-ции) прибавить массу растворившейся меди:
m(смеси)=0,16(г)+2,065(г)=2,225 (г)
w(Cu)=0,16(г)/2,225(г)=0,072 (7,2%)
Далее рассчитаем массу алюминия:
n(H2)=1,344(л)/22,4(л/моль)=0,06 моль
Из реакции (2) следует:
n(H2)/n(Al)=3/2 ⇒ n(Al)=2*n(H2)/3=2*0,06(моль)/3=0,04 моль
m(Al)=0,04*27=1,08 (г)
w(Al)=1,08(г)/2,225(г)=0,485 (48,5%)
w(Au)=100-48,5-7,2=44,3%
ответ:w(Cu)=7,2%; w(Al)=48,5%; w(Au)=44,3%.