
1. Докажите опытным путём состав: а) гидроксида кальция; б) сульфата аммония.
а) Проведём качественную реакцию на гидроксид-ион. Для этого воспользуемся индикаторами. Гидроксид кальция - основание малорастворимое, но тем не менее некоторое количество растворяется, следовательно среду изменять будет. Возьмём индикатор фенолфталеин, добавим его в пробирку с гидроксидом кальция, в результате раствор частично изменит цвет на малиновый - следовательно среда щелочная (слабощелочная).
б) Проведём качественную реакцию на сульфат-ион. Для этого возьмём любую растворимую соль бария (по стандарту - хлорид бария), добавим его в раствор с сульфатом аммония. В ходе реакции выпадает белый осадок - сульфат бария. Реакция выглядит следующим образом:
ᅠᅠ
2. Испытайте растворы нитрата натрия, карбоната натрия и нитрата цинка раствором индикатора или индикаторной бумагой, и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза:
1. Нитрат натрия - соль, образованная сильным основанием NaOH и сильной кислотой HNO₃, гидролиз протекать не будет, среда нейтральная. Это можно доказать следующим путём: возьмём индикатор метиловый оранжевый, добавим его в раствор нитрата натрия, в результате цвет изменится на оранжевый. Это и есть признак нейтральной среды.
2. Карбонат натрия - соль, образованная сильным основанием NaOH и слабой кислотой H₂CO₃. Гидролиз протекает по аниону, образующаяся среда - щелочная, гидролиз обратимый, протекает в две стадии:
ᅠᅠ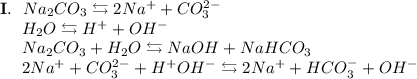
ᅠᅠ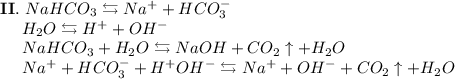
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на жёлтый, следовательно реакция среды щелочная.
3. Нитрат цинка - соль, образованная слабым основанием Zn(OH)₂ и сильной кислотой HNO₃. Гидролиз протекает по катиону, образующаяся среда - кислая, гидролиз обратимый, протекает в две стадии:
ᅠᅠ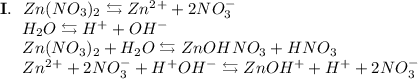
ᅠᅠ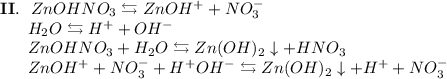
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на красный, следовательно реакция среды кислая.
3. Практически осуществите все следующие превращения: 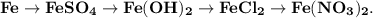
1. Получим сульфат железа путём реакции железа и разбавленной серной кислоты:
ᅠᅠ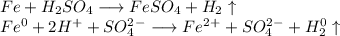
С точки зрения ОВР:
ᅠᅠ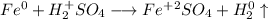
ᅠᅠ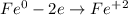 | 2 | 1 | окисление
| 2 | 1 | окисление
ᅠᅠ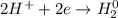 | 2 | 1 | восстановление
| 2 | 1 | восстановление
ᅠᅠFe - восстановитель, H₂SO₄ (2H⁺) - окислитель.
2. Получим гидроксид железа путём реакции сульфата железа и гидроксида калия:
ᅠᅠ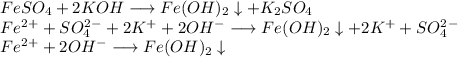
3. Получим хлорид железа путём реакции гидроксида железа и хлороводородной кислоты:
ᅠᅠ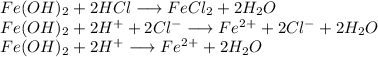
4. Получим нитрат железа путём реакции хлорида железа и азотной кислоты:
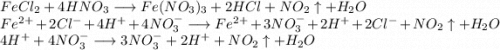
І рівень.
1) в
2) б
3) б
ІІ рівень.
1) Оксиди - це неорганічні бінарні сполуки, до складу яких входить Оксиген у ступені окиснення.
2) Середні солі (2CH3COOH + Mg(ОН)2 = Mg(CH3COO)2 + 2H2O)
Кислі солі (NaOH + H2SO4 = NaHSO4 + H2O)
Основні солі (Cu(OH)2 + HCl = Cu(OH)Cl ↓ + H2O)
3) а
ІІІ рівень.
1) H2SO4, HNO3, HCl, H2S.
2) а) K2O + H2O = 2KOH б) Ba(OH)2 + 2HCl = 2H2O + BaCl2 в) 2Na + 2H2O = NaOH + H2
IV рівень
1) n=0,5 моль
Mr(HCl) = 1*35,5
M(HCl) = 35,5 г/моль
m=M*n
m(HCl) = 35,5 г/моль*0,5 моль = 17,75 г
(моль сокращается и остаются граммы)
ответ: 17,75 г
2) CaCO = Ca + CO2
CaO + H2O = Ca(OH)2
Ca(OH)2 + SO3 = CaSO4 + H2O
Ca(OH)2 + K2CO3 = CaCO3 (стрелка вниз, идет в осадок) + KOH
KOH + HCl = KCl + H2O
Объяснение: