ответ: 52.8грамм
Объяснение:
Есть известь негашеная - CaO (оксид кальция II)
А есть гашеная - Ca(OH)2 (гидроксид кальция)
Также есть известь как материал - CaO и MgO
Процесс нагревания означает реакцию разложения, то есть в выходе будут только те атомы, которые были в исходных продуктах. А во всех предложенных известях нет углерода, поэтому углекислый раз в принципе не образуется. Поэтому задача нерешаема.
НО есть известь воздушная или же мел - CaCO3, который уже подходит и делает реакцию
CaCO3→СаО+СО2↑
Если идти так, то задача крайне тривиальна, так как количество молей углекислого газа и извести совпадает. То есть n(CaCO3)=n(CO2)
n(CaCO3)=m(CaCO3)/M(CaCO3)
m(CO2)=n(CO2)*M(CO2)=n(CaCO3)*M(CO2)=m(CaCO3)/M(CaCO3)*M(CO2)=
=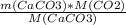 =
= =52.8 г.
=52.8 г.
Дано:
m(CaCO3)=120г.
Найти: m(CO2)
Решение расписал
3 моль Х л
2С6Н14 + 19 О2 = 12СО2 + 14Н2О
n = 2 моль n = 19 моль
Vm=22,4 л/моль
V = 425,6 л
3 моль С6Н14 - Х л О2
2 моль С6Н14 - 425,6 л
V(O2) = 3 * 425,6 / 2 = 638,4 л