ответ: 7,1 г
Дано:
m(Na) = 2,3 г
Найти:
m(Na₂SO₄)-?
Объяснение:
Сульфат натрия Na₂SO₄ можно получить разными к примеру:
1) 2Na + H₂SO₄ = Na₂SO₄ + H₂
2) 4Na + O₂ = 2Na₂O
Na₂O + H₂SO₄ = Na₂SO₄ + H₂O
3) 4Na + O₂ = 2Na₂O
Na₂O + SO₃ = Na₂SO₄
4) 4Na + O₂ = 2Na₂O
Na₂O + H₂O = 2NaOH
2NaOH + H₂SO₄ = Na₂SO₄ + 2H₂O
5) 4Na + O₂ = 2Na₂O
Na₂O + H₂O = 2NaOH
2NaOH + SO₃ = Na₂SO₄ + H₂O и т.д.
Если все перечисленные схемы получения сульфата натрия проанализировать, то получиться в количественном отношении теоретически можно получить в 2 раза меньше в молях сульфата натрия по сравнению с количеством в молях натрия.
Проводим расчеты:
М(Na) = 23 г/моль
n(Na) = m(Na)/M(Na) = 2,3 г/23 г/моль = 0,1 моль
М(Na₂SO₄)= 142 г/моль
n(Na₂SO₄) = 0,5*0,1 моль = 0,05 моль
m(Na₂SO₄) = n(Na₂SO₄)*M(Na₂SO₄)
m(Na₂SO₄) = 0,05 моль*142 г/моль = 7,1 г
ответ: 7,1 г
Привет)
Гидриды щелочно-земельных металлов имеют формулу RH2
То есть в их соединении 2 атома водорода)
100%-95.24% = 4.76% это массовая доля водорода в составе гидрида металла
Если формула RH2 и массовая доля водорода 4.76%, то можно найти молекулярную массу состава рассчитав:
2 ÷ 0.0476 = 42 грамм
42-2 (H2) = 40 грамм - это кальций
Значит формула CaH2
Перейдем к задаче:
CaH2 + 2H2O = Ca(OH)2 + 2H2
m(CaH2) = 1.2 грамм
n(CaH2) = 1.2/42 = 0.02857 моль
CaH2 и H2 находятся в молярном соотношении 1 к 2, значит:
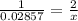
x= 0.05714 моль водорода
v(H2) = 0.05714 × 22.4 = 1.28 литра выделилось газа(ответ 1)
Так как CaH2 и Ca(OH)2 находятся в молярном соотношении 1 к 1, то Ca(OH)2 образовалось тоже 0.02857 моль
m(Ca(OH)2) = 0.02857 × 74 = 2.11 грамм
Так же у нас улетучилось 0.05714 моль водорода
m(H2) = 0.05714 × 2 = 0.11 грамм
Находим массовую долю:
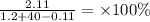
=5.13%
ответ: 1.28 литра газа и 5.13%
120 164
находим массу щелочи в растворе; м(NaOH) = 200*20%/100% = 40г
находим массу соли (Na3РО4); м (Na3РО4) = 40*164/120 = 54,7г