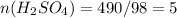 моль
моль
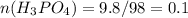 моль
моль
Карбонат калия- 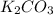
сульфид свинца(II)- 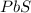
нитрат железа(III)- 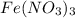
хлорид свинца (IV)- 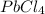
фосфат магния- 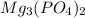
нитрат алюминия- 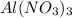
MgCl2+CO2(соль+кислотный оксид≠)
MgCl2+Na2SO4(в конце обе соли растворимые,реакция не идёт)
MgCl2+2NaOH=Mg(OH)2+2NaCl
MgCl2+Na2CO3=MgCO3+2NaCl
MgCl2+NaCl(кислотный остаток одинаковый,реакция не идёт)
MgCl2+HCl(см реакцию)
MgCl2+H2SO4=2HCl+MgSO4
MgCl2+2HNO3=2HCl+Mg(NO3)2
FeO+CO2=FeCO3
FeO+Na2SO4(основный оксид+соль≠)
FeO+NaOH(основный оксид+основание≠)
FeO+Na2CO3(см.две реакции)
FeO+NaCl(см реакцию)
FeO+2HCl=FeCl2+H2O
FeO+H2SO4=FeSO4+H2O
FeO+2HNO3=Fe(NO3)2+H2O
Ba(OH)2+CO2=BaCO3+H2O
Ba(OH)2+Na2SO4=2NaOH+BaSO4
Ba(OH)2+NaOH(основание+основание≠)
Ba(OH)2+Na2CO3=2NaOH+BaCO3
Ba(OH)2+NaCl(оба конечных вещества растворимые,реакция не идёт)
Ba(OH)2+2HCl=BaCl2+2H2O
Ba(OH)2+H2SO4=BaSO4+2H2O
Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
а)хлорид магния-2)NaOH, Na2CO3 и 4)H2SO4,HNO3
б)оксид железа(II)-4)H2SO4,HNO3
в)гидроксид бария-1)CO2,Na2SO4 и 4)H2SO4,HNO3
Mn → MnO4−
Полуреакция восстановления: MnO4− + 8H+ + 5ē → Mn2+ + 4H2O , fэкв.(MnO4−) = 1/5 ,
полуреакция окисления: H3AsO3 + H2O − 2ē = H3AsO4 + 2H+ + 2e , fэкв.(H3AsO3) = ½.
nэ(MnO4−) = nэ(H3AsO3)
nэ(MnO4−)=nэ(Mn) = m(Mn)/Mэ(Mn) = m(стали) ∙ ω /M(1/5Mn)
nэ(H3AsO3)=Cн ∙ V
Cн(H3AsO3)=m(стали)∙ω/(M(1/5Mn) ∙ V)= 0,2548 г ∙ 0,0109 / (10,99 г/моль ∙ 0,01850 л) = 0,01366 н
Т(H3AsO3/Mn) = nэ(H3AsO3) ∙ M(1/5Mn) / V= Cн ∙ V (л) ∙ M(1/5Mn) / V (мл) =
Cн ∙ M(1/5Mn) /1000 = 0,01366 моль/л ∙ 10,99 г/моль / 1000 мл/л = 0,0001501 г/мл
Объяснение:
1. n = m/M
M(H2SO4) = 1*2 + 32 + 16*4 = 98 г/моль
n(H2SO4) = 490 г / 98 г/моль = 5 моль
M(H3PO4) = 1*3 + 31 + 16*4 = 98 г/моль
n(H3PO4) = 9,8 г /98 г/моль = 0,1 моль
2. Карбонат калия -K2CO3
сульфид свинца (II)- PbS
нитрат железа (III) -Fe(NO3)3
хлорид свинца (IV) -PbCl4
фосфат магния -Mg3(PO4)
нитрат алюминия - Al(NO3)3
3. H2S, K2So3, KOH, SO3,Fe(OH)3, FeO, N2O3, Cu3(PO4)2, Cu2O, P2O5, H3PO4
Оксиды: SO3, FeO, N2O3, Cu2O, P2O5.
Кислоты: H2S, H3PO4.
Основания: КОН, Fe(OH)3.
Соли: K2So3, Cu3(PO4)2.