165,5 г,х г 75 г у г
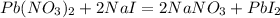
327 г 300 г 461 г
1. Найдем чистую массу нитрата свинца,умножив массу раствора на массовую долю нитрата в нем(25% - это 0,25):
m(Pb(NO3)2)=m1(раствора)*w(Pb(NO3)2)=662*0,25=165,5 г
2. Теперь необходимо определить чистую массу йодида в растворе:
m(NaI)=m2(раствора)*w(NaI)=150*0,5=75 г
3. Чтобы определить по массе какой из исходных веществ вести расчет массы образовавшегося осадка,следует сначала определить какое из исходных веществ прореагирует полностью(без остатка),а для этого примем одно из этих веществ за Х,например,массу нитрата свинца:
для полного взаимодействия 327 г нитрата необходимо 300 г йодида, а
для -- // -- х г_____________________75 г, откуда
х=327*75/300=81,75 г
4. Из последних расчетов видно,что нитрат свинца дан в избытке и прореагирует с остатком,значит массу осадка ведем по массе йодида натрия:
при взаимодействии 300 г йодида натрия выпадает в осадок 461 г йодида свинца,а при - //- 75 г_______________________________у г, откуда
у=75*461/300=115,25 г
1680 г х л
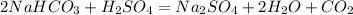
168 г 22,4 л
1. Сначала переведем объем раствора в массу через плотность,учитывая,что 20 л - это 20 000 мл или 20 000 см в кубе:
m(раствора)=V*р(ро)=20 000* 1,05=21 000 г
2. Теперь определим чистую массу гидрокарбоната в растворе,учитывая,что 8% - это 0,08(но без %):
m(NaHCO3)=m(раствора)*w(NaHCO3)=21 000*0,08=1680 г
3. А теперь,подставив эту массу в уравнение,решаем как обычно с пропорции:
при взаимодействии 168 г гидрокарбоната выделится 22,4 л углекислого газа, а
при -- \\ -- 1680 г_______________________х л, откуда
х=1680*22,4/168=224 л