ответ:ω%(FeCI3)=21,5%
ω%(HCI)=3%
Объяснение:
Дано:
m(Fe(OH)3)=40г
m(тв.осадка)=35г
V(р-рHCI)=240мл
ρ(р-р)=1,03г/мл
ω%(HCI)=20%
--------------------------
Найти:
массовые доли веществ в конечном растворе.
в начале проверить полностью или частично разлагается Fe(OH)3:
2Fe(OH)3→Fe2O3+3Н2О
Найдем количества вещества Fe(OH)3
М(Fe(OH)3)=107г/моль
ν(Fe(OH)3)=40г/107г/моль=0,3738моль
Допустим разлагается х моль Fe(OH)3
Тогда получим 40-107х+80х=35
27х=5,х=0,1852моль.Это означает,что Fe(OH)3 разложился не полностью,Смесь состоит из 80*0,1852=14,8г Fe2О3 и (0,3738-0,1852)*107=20,2г Fe(OH)3
Обе вещества реагируют с кислотой
Fe(OH)3+3HCl→FeCI3+3H2O (1)
Fe2О3+6HCl→2FeCI3+3H2O (2)
Находим массу кислоты в р-ре
m(HCI)=ωρV/100=240*1,03*20/100=49,44г
ν(HCI)=49,44/36,5=1,3545 моль
В смеси было 0,0928 моль Fe2О3 и 0,1886 моль Fe(OH)3.По (1) реакции вступает в реакцию 0,1886*3=0,5658 моль кислоты и образуется 0,1886 моль FeCI3.По реакции (2) используется 6*0,0926=0,5556 моль кислоты и образуется 2*0,0926=0,1852 моль FeCI3, всего образуется 0,1886+0,1852=0,3738 моль FeCI3
Его масса 0,3738*162,5=60,7425г
общее количества израсходованного кислоты:
0,5658+0,556=1,1214 моль,в избытке остается 1,3545-1,1214=0,2331 моль,масса этой кислоты 0,2331*36,5г=8,5г
Масса раствора: 35+240*1,03=282,2г
ω%(FeCI3)=60,7425*100/282,2=21,5%
ω%(HCI)=8,5*100/282,2=3%


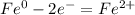
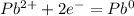
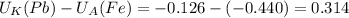 В (Вольт)
В (Вольт) то ЭДС необходимо рассчитать с формулы Нернста:
то ЭДС необходимо рассчитать с формулы Нернста:![((U_{K})^o+ \frac{0,059}{n}lg[Me^{n+}]_k)-( (U_{A})^o)+ \frac{0,059}{n}lg[Me^{n+}]_a )](/tpl/images/0408/4708/bd0bf.png)
 В (Вольт)
В (Вольт)
ответ: Fe(OH)3 разложился частично; в конечном р-ре 21,52% FeCl3 и 3,01% HCl.
Объяснение: