1. неметалл а) na в) c с) ag d) mn е) ca 2. 5 моль хлора занимают объём (н.у.) а) 89,6л в) 56л с) 112л d) 100л е) 44,8л 3. при нагревании 6,5г цинка и 6,4г серы образуется сульфид цинка массой а) 8,7г в) 19,4г с) 4,6г d) 9,7г е) 8,1г 4. неправильно определена степень окисления азота в соединении а) n2+1o в) n2+5o5 с) n+2o d) n+3h3 е) n2+3o3 5. формула высшего оксида элемента, находящегося в 3 периоде, v группе, главной подгруппе а) as2o5 в) nb2o5 с) p2o5 d) v2o5 е) n2o5 6. электронная формула атома кремния а) 1s22s22p3 в) 1s22s2 2p63s2 с) 1s22s22p63s23p1 d) 1s22s22p1 е) 1s22s22p63s23p2 7. металлы расположены в порядке возрастания металлических свойств в ряду а) k, na, li в) ca, sr, ba с) na, mg, al d) cs, rb, k е) ba, mg, be 8. коэффициент перед калием в уравнении реакции: к + s = k2s а) 1 в) 2 с) 3 d) 4 е) 5 9. с выделением газа идёт реакция а) cacl2 + na2co3 в) cao + co2 с) cacl2 + agno3 d) ca(oh)2 + hcl е) caco3+hcl 10. масса алюминия, вступившего в реакцию с серой, если получилось 75г сульфида алюминия а) 54г в) 2,7г с) 5,4г d) 27г е) 13г
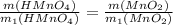
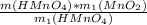
2 С
3 D
4 D
5 C
6 Е
7 В
8 В
9 Е
10 D