
Дано:
m (мыла) = 250 г
w (C17 H35COONa) = 68%
w выхода – 92 %
Найти:
m (C17H35COOH) -?
170 г х г
306*2 284*2
1. Найдем массу стеарата натрия:
m(C17 H35COONa) = 250×0,68= 170 г
М(C17 H35COONa) = 306 г/моль
М(C17H35COOH) = 284 г/моль
2. Чтобы найти массу стеариновой кислоты, составим пропорцию
170*284*2 = х*306*2
х = 96560/612 = 157, 78 г
5. Найдем массу m(C17H35COOH) с выходом кислоты 92%:
157,78×0,92 = 145,16 г
ответ: 145,16 г
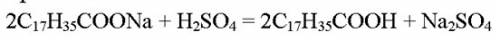
CaCO₃ + 2HCl = CaCl₂ + CO₂↑ + H₂O
Сa²⁺ +CO₃²⁻ +2H⁺ + 2Cl⁻= Ca²⁺ + 2Cl⁻ + CO₂ +H₂O
CO₃²⁻ + 2H⁻ = CO₂ + H₂
Наличие кальция в скорлупе доказать можно действием щелочи на
скорлупу - появляется нерастворимый осадок гидроксида кальция:
CaCO₃ + 2 NaOH = Ca(OH)₂ ↓+ Na₂CO₃
Ca²⁺ + CO₃²⁻ + 2Na⁺ + 2 OH⁻ = Ca(OH)₂ + 2Na⁺ + CO₃²⁻
Ca²⁺ + 2OH⁻ = Ca(OH)₂