Дано:
m(р-ра NaOH) = 50 гр
ω(NaOH) = 10%
Найти:
m(C₁₇H₃₅-COONa) - ?
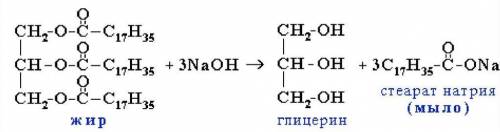
1) Для начала мы напишем уравнение реакций, то что известно по условию задачи, именно по такой уравнений реакций мы будем пользоваться. Уравнение этой реакций представлен внизу↓.
2) Далее находим массу чистого вещества у гидроксида натрия, а потом его количества вещества, и потом количества вещества у образовавшейся соли по уравнению реакций:
m(NaOH) = (m(р-ра NaOH)×ω(NaOH))/100% = (50 гр × 10%)/100% = 50 гр × 0,1 = 5 гр
M(NaOH) = 23 + 16 + 1 = 40 гр/моль
n(NaOH) = m(NaOH)/M(NaOH) = 5 гр / 40 гр/моль = 0,125 моль
n(NaOH) : n(C₁₇H₃₅-COONa) = 3 : 3 = 1 : 1 ⇒ n(C₁₇H₃₅-COONa) = n(NaOH) = 0,125 моль - по уравнению реакций
3) Теперь находим массу образовавшейся соли:
M(C₁₇H₃₅-COONa) = 12×18 + 1×35 + 16×2 + 23 = 216 + 35 + 32 + 23 = 306 гр/моль
m(C₁₇H₃₅-COONa) = n(C₁₇H₃₅-COONa)×M(C₁₇H₃₅-COONa) = 0,125 моль × 306 гр/моль = 38,25 гр
ответ: m(C₁₇H₃₅-COONa) = 38,25 гр
Решено от : 
Объяснение:
Задание 4
Cu(OH)2(tC)-->CuO+H2O
CuO+2HNO3-->Cu(NO3)2 + H2O
Задание 5
SO3 + H2O -> H2SO4
H2SO4 + 2KOH-> K2SO4 + 2H2O
K2SO4 + Ba(OH)2 -> BaSO4 + 2KOH
2KOH+CuCl2->2KCl+Cu(OH)2
Задание 6
4P+5O2=2P2O5
P2O5+3H2O=2H3PO4
H3PO4 + 3KOH = K3PO4 + 3H2O
Задание 7
K2O + H2O = 2KOH
Al2(SO4)3 + 6KOH = 2Al(OH)3 + 3K2SO4
CuCl2 + 2 KOH → Cu(OH)2 + 2 KCl
FeCl 3 + 3 KOH → Fe(OH) 3 + 3 KCl
1) CuO+H2SO4=CuSO4+H2O
2) CuO+HNO3разб=Cu(NO3)2+H2O
3) Cu(NO3)2+2NaOH=Cu(OH)2+2NaNO3
4) CuSO4+2NaOH=Cu(OH)2+Na2SO4
5) Cu(OH)2 (t=200C) =CuO+H2O
MgCO₃ → MgO + CO₂↑
1 моль 1 моль 1 моль (22,4 л)
0,25 моль 0,25 моль ()
Vm - молярный объем (объем, занимаемый одним моль вещества, для всех газов это величина постоянная при постоянных давлении и температуре и равна 22,4 литра при нормальных условиях - давлении 1 атмосфера и температура 273 К)
Количество вещества выделившегося оксида углерода (углекислого газа CO₂) равно:
n(CO₂) = V(CO₂) / Vm = 5,6 л / 22,4 л/моль = 0,25 моль
Согласно уравнению реакции, образовалось такое же количество вещества оксида магния
n(MgO) = n(CO₂) = 0,25 моль.
Масса образовавшегося оксида магния m(MgO) = n(MgO)*M(MgO) = 0.25 моль * 40 г/моль = 10 г.
В состав твердого остатка входят неразложившийся карбонат магния и образовавшийся оксид магния. Общая масса остатка 18,4 г. Масса оксида магния 10 г. Тогда масса неразложившегося карбоната магния 18,4-10 = 8,4 г. (Допускаем, что примесей других веществ нет)
Оба вещества реагируют с соляной кислотой. В ходе реакции часть соляной кислоты (хлороводорода HCl) расходуется, ее масса, и соответственно, ее массовая доля уменьшается. Рассчитаем массу израсходованной кислоты.
MgCO₃ + 2 HCl → MgCl₂ + H₂O + CO₂↑
84 г 2*36,5 г
8,4 г х г
х = 8,4*2*36,5/84 = 7,3 г
MgO + 2 HCl → MgCl₂ + H₂O
40 г 2*36,5 г
10 г у г
у = 10*2*36,5/40 = 18,25 г
Масса израсходованной соляной кислоты 7,3+18,25 = 25,55 г
Пусть массовая доля кислоты (хлороводорода HCl) в исходном растворе была w.
Тогда масса кислоты в исходном растворе была w*m(раствор) = 365w г.
Тогда масса кислоты после растворения остатка стала 365w-25,55 г.
Массовая доля кислоты изменяется не только за счет ее расходования, но и из-за изменения массы раствора. (Например, если к раствору соляной кислоты прилить воду, то массовая доля кислоты снизится, хотя кислота ни на какую реакцию не расходуется).
Масса раствора после растворения остатка равна сумме масс исходного раствора кислоты (365 г) и массе добавленного твердого остатка (18,4 г)
Однако надо учесть, что масса еще и уменьшилась за счет выделившегося оксида углерода (углекислый газ улетучивается). Найдем массу выделившегося CO₂.
MgCO₃ + 2 HCl → MgCl₂ + H₂O + CO₂↑
84 г 44 г
8,4 г х г
х = 8,4*44/84 = 4,4 г
Итоговая масса раствора равна 365 + 18,4 - 4,4 = 379 г.
По условию задачи массовая доля кислоты в итоговом растворе 2,9% или 0,029.
Выражение для массовой доли кислоты в итоговом растворе имеет вид:
(365w-25,55) / 379 = 0,029 (массу кислоты делим на массу раствора)
Решая это уравнение относительно w, получим массовую долю кислоты в исходном растворе.
(365w-25,55) / 379 = 0,029
365w-25,55 = 0,029*379 = 10,99
365w = 10,99 + 25,55 = 36,54
w = 36,54/365 = 0,100 = 10%
ответ: 10%