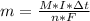 Для нахождения молярной концентрации нам понадобится количество вещества, что бы его найти, нужно массу поделить на молярную, запишем II закон Фарадея, с поделенной молярной массой:
Для нахождения молярной концентрации нам понадобится количество вещества, что бы его найти, нужно массу поделить на молярную, запишем II закон Фарадея, с поделенной молярной массой: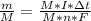 видим, что в правой части М - молярная масса - сократится и останется:
видим, что в правой части М - молярная масса - сократится и останется: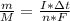 , теперь разберемся, что здесь к чему, I - сила тока(А), Δt - время за которое электролиз, n - число электронов, участвующих в электролизе, F - число Фарадея = 96500 А*сек/моль, все это теперь вставим в формулу и оцифруем, я буду писать без единиц измерения.
, теперь разберемся, что здесь к чему, I - сила тока(А), Δt - время за которое электролиз, n - число электронов, участвующих в электролизе, F - число Фарадея = 96500 А*сек/моль, все это теперь вставим в формулу и оцифруем, я буду писать без единиц измерения.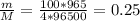 моль
моль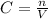 , только объем нужен в литрах, что и сделаем,
, только объем нужен в литрах, что и сделаем,
W(Ca(OH)2=20%
m(Ca)=4 g
m(ppa CaOH)2)-?
4g Xg
Ca+2H2O-->Ca(OH)2+H2 M(Ca)=40 g/mol , M(Ca(OH)2)=74 g/mol
40 74
X=4*74/4=74 g
m(ppaCa(OH)2)=74*100%/20%=370 g
ответ 370 г