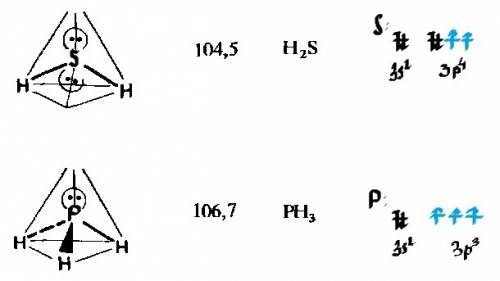
Геометрия молекул H₂S и PH₃ обусловлена sp³-гибридизацией и отталкиванием электронных пар друг от друга. Неподелённые электронные пары отталкиваются от поделённых. В мол-ле H₂S неподелённых пар 2, а в фосфине-1 неподелённая пара, поэтому отталкиваний непод. пар от подел. в молекуле фосфина будет меньше,чем в H₂S, а, значит, валентный угол HЭН в фосфине будет больше(≈107°), чем в молекуле сероводорода.Соответственно, валентный угол НЭН в H₂S будет меньше(≈104°), чем в фосфине, поскольку кол-в неподелённых пар больше,что обуславливает большее отталкивание и уменьшение валентного угла.Более конкретно насчёт геометрии молекул:фосфин имеет пирамидальное строение, а сероводород- угловое.
Пишу полное решение. Переписывать только то, что после моих рассуждений.
Дано:
Уравнение реакции: 2Ca + O2 >>> 2CaO
пояснение к уравнению реакции при необходимости: кальций + кислород >>> оксид кальция)
m(CaO) = 9 г.
Найти: m(O2) и n(O2)
1) Находим моль известного нам вещества (оксида кальция) по формуле n=m/M (где m - известная нам масса, а M - молярная масса вещества) - M(CaO) = 56 г/моль
n(CaO) = m/M = 9 / 56 = 0,16 моль
2) Сравниваем моль оксида кальция и вещества, которое нам необходимо найти (кислорода). Видим, что они реагируют 2:1, т.е. кислорода в 2 раза меньше, чем оксида кальия (цифры в уравнении реакции перед веществами)
т.к. n(CaO) = n(O2) = 2:1 ⇒ n(O2) = 0,16 / 2 = 0,08 моль
3) Находим массу вещества по формуле m=n*M (где n - известные нам моль вещества, а M - молярная масса вещества) - M(O2) = 32 г/моль
m(O2)= 32 * 0,08 = 2,56 г.
Поскольку изначально было мало грамм вещества - отсюда и такой маленький результат.
ответ: m(O2)= 2,56 г ; n(O2) = 0,08 моль.
Если есть вопросы - пиши в комментарии

2K⁺ + SiO3²⁻ + 2H⁺ + SO4²⁻ ⇒ 2K⁺ + SO4²⁻ + H2SiO3↓ (полное ионное уравнение)
SiO3²⁻ + 2H⁺ ⇒ H2SiO3↓ (сокращённое ионное уравнение)
2) H2SiO3 =[ t°c ]⇒ SiO2 + H2O
3) SiO2 + 2Mg =[ t°c ]⇒ Si + 2MgO
Si⁺⁴ + 4ê → Si⁰ l 1 - процесс восстановления
Mg⁰ - 2ê → Mg⁺² l 2 - процесс окисления
Si⁺⁴ + 2Mg⁰ → Si⁰ +2Mg⁺²
Si⁺⁴ (SiO2 за счёт Si⁺⁴) - окислитель
Mg⁰ - восстановитель