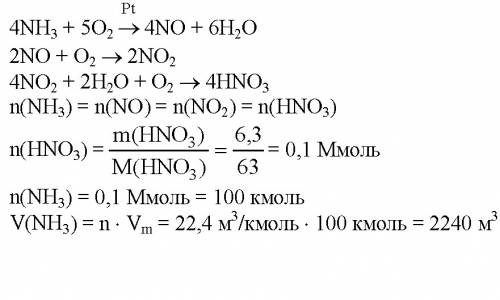
Объяснение:
Задание № 2
Дано: 4Fe + 3O2 = 2Fe2O3
m(Fe2O3) = 64 г
Найти:
Q-?
Сначала мы должны узнать на какое количество моль Fe2O3 выделяется 328,88 кДж тепла.
Формула для вычисления моль: , где m - масса вещества, а M - его [вещества] молярная масса.
1. n(Fe2O3) = m/M= 64/160 = 0,4 моль. - теперь мы знаем, что на 0,4 моль нам требуется 328,88 кДж тепла.
Можем составить пропорцию и узнать сколько нам требуется на 1 моль (что и будет ответом на вопрос задачи).
2. Пропорция:
0,4 моль - 328,88 кДж тепла
1 моль - х кДж тепла.
Q = 328,88/0,4 = 822,2 (кДж)
Высчитываем:
Значит, на 1 моль Fe2O3 требуется 822,2 кДж тепла.
ответ: 822,2 кДж

Объяснение:
Дана схема реакции (см. вариант в табл. 2): 1) определите степень окисления атомов элементов, меняющих ее в процессе реакции; 2) составьте электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов, укажите процессы окисления и восстановления; 3) запишите множители в уравнение окислительно-восстановительной реакции как основные стехиометрические коэффициенты; 4) подберите стехиометрические коэффициенты остальных участников реакции; 5) выпишите формулы вещества – окислителя и восстановителя, рассчитайте их молярные массы эквивалентов.
₊₆ ₋₁ ₊₃ ₀
K2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 3I2↓ + 4K2SO4 + 7H2O
2Cr⁺⁶ + 6e = 2Cr⁺³ восстановление, K2Cr2O7 - окислитель ║1
2I⁻ - 2e = I₂⁰ окисление, KI - восстановитель ║3
K2Cr2O7 - окислитель М экв 49,032 г/моль
KI - восстановитель М экв 83,003 г/моль