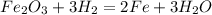
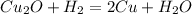
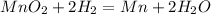
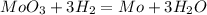
Все реакции протекают при повышенной температуре(нагревании)
Молекулярная формула аммиака NH3. Три атома водорода соединены с азотом ковалентными полярными связями (азот более электроотрицателен). В образовании связей принимают участие три неспаренных электрона азота и по одному электрону водорода. Структурная формула:
H – N – H
l
H
Молекула аммиака имеет форму треугольной пирамиды, в вершинах которой находятся атомы азота и водорода. Угол между связями N–H около 107о
Для получения и собирания аммиака в лаборатории насыпаем в пробирку хлорид или сульфат аммония, смешанный с известью Ca(OH)2, затыкаем пробкой с газоотводной трубкой. Трубку вставляем в колбу, перевернутую вверх дном, – аммиак легче воздуха. Отверстие колбы закрываем куском ваты.
Осторожно нагреваем пробирку на спиртовке. Уравнение реакции:
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑
Аммиак обнаруживаем по характерному резкому запаху (нюхать осторожно!) или поднеся к трубке бумажку, смоченную раствором фенолфталеина (ф-ф). Бумажка розовеет вследствие образования гидроксид-ионов:
NH3 + HOH NH4+ + OH –
а) Fe2O3 + 3H2 = 2Fe + 3H2O
б) Cu2O + H2 = 2Cu + H2O
в) MnO2 + 2H2 = Mn + 2H2O
г) MoO3 + 3H2 = Mo + 3H2O
Во всех реакциях над знаком равно ставь t ( реакция протекает при нагревании )