В порции озона. 3,6*10^20 против 2,4*10^13.
Объяснение:
Итак, основная формула - применяемая в этой задаче
N = 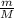 *Na, Na - число Авогадро, равное 6,022*10^23 моль⁻1, а N - число молекул
*Na, Na - число Авогадро, равное 6,022*10^23 моль⁻1, а N - число молекул
Для озона все проще - 0,0096 г/46 г/моль * 6,022*10^23 моль⁻1, ≈ 1,2044*10^20
Для кислорода все на шаг дольше, поскольку дан объем, а не масса. Эти две величины связаны соотношением V = 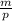 , отсюда m = V*p
, отсюда m = V*p
N = 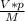 *Na = (0,00000448 м^3* 0,00143 г/м^3) * 6,022*10^23 моль⁻1, /32 г/моль ≈ 1,2056*10^13
*Na = (0,00000448 м^3* 0,00143 г/м^3) * 6,022*10^23 моль⁻1, /32 г/моль ≈ 1,2056*10^13
В молекуле озона - три атома, кислорода - два атома. 3,6*10^20 против 2,4*10^13. Очевидно, в данной порции озона атомов больше, чем в данной порции кислорода.
Я не применял формулу 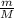 =
= 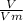 ; поскольку не указаны условия, а известное в пособиях значение константы Vm применяем для нормальных условий.
; поскольку не указаны условия, а известное в пособиях значение константы Vm применяем для нормальных условий.
Объяснение:
1) FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl (гидроксид железа(II), хлорид натрия) (зеленоватый осадок)
Fe(2+) + 2Cl(-) + 2Na(+) + 2OH(-) = Fe(OH)2↓ + 2Na(+) + 2Cl(-)
Fe(2+) + 2OH(-) = Fe(OH)2↓
Al2(SO4)3 + 3BaCl2 = 3BaSO4 ↓+ 2AlCl3 (сульфат бария, хлорид алюминия) (белый мелкокристаллический осадок)
2Al(3+) + 3SO4(2-) + 3Ba(2+) + 6Cl(-) = 3BaSO4↓ + 2Al(3+) + 6Cl(-)
Ba(2+) + SO4(2-) = BaSO4↓
KI + AgNO3 = AgI↓ + KNO3 (иодид серебра, нитрат калия) ( жёлтый творожистый осадок)
K(+) + I(-) + Ag(+) + NO3(-) = AgI↓ + K(+) + NO3(-)
Ag(+) + I(-) = AgI↓
CuCl2 +2 AgNO3 =2 AgCl ↓+ Cu(NO3)2 (хлорид серебра, нитрат меди) (белый творожистый осадок)
Cu(2+) + 2Cl(-) + 2Ag(+) + 2NO3(-) = 2AgCl↓ + Cu(2+) + 2NO3(-)
Ag(+) + Cl(-) = AgCl↓
2) H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl (сульфат бария, соляная кислота) (белый мелкокристаллический осадок)
2H(+) + SO4(2-) + Ba(2+) + 2Cl(-) = BaSO4↓ + 2H(+) + 2Cl(-)
Ba(2+) + SO4(2-) = BaSO4↓
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl (гидроксид меди, хлорид натрия) ( синий осадок)
Cu(2+) + 2Cl(-) + 2Na(+) + 2OH(-) = Cu(OH)2↓ + 2Na(+) + 2Cl(-)
Cu(2+) + 2OH(-) = Cu(OH)2↓
NaCl + AgNO3 = AgCl↓ + NaNO3 (хлорид серебра, нитрат натрия) ( белый творожистый осадок)
Na(+) + Cl(-) + Ag(+) + NO3(-) = AgCl↓ + Na(+) + NO3(-)
Ag(+) + Cl(-) = AgCl↓
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl (гидроксид железа, хлорид натрия) ( бурый осадок)
Fe(3+) + 3Cl(-) + 3Na(+) + 3OH(-) = Fe(OH)3↓ + 3Na(+) + 3Cl(-)
Fe(3+) + 3OH(-) = Fe(OH)3↓
3) смотри выше
а) 2CuCl₃+3Mn=3MnCl₂+2Cu реакция замещения
б) Fe₂O₃+3CO=2Fe+3CO₂↑ реакция обмена
в) 2KClO₃=2KCl+3O₂↑ реакция разложения
г) CO+O₂=CO₂↑ реакция соединения
Все реакции окислительно-восстановительные.
2. Составьте уравнения реакций, расставьте коэффициенты:
а) сульфат калия + гидроксид бария=гидроксид калия+сульфат бария
K₂SO₄ + Ba(OH)₂=KOH + BaSO₄↓
б) нитрат серебра + хлорид магния=нитрат магния+хлорид серебра
AgNO₃ + MgCI₂=Mg(NO₃)₂+AgCI↓
в) Mg+H₂SO₄=MgSO₄+H₂↑
3. Cколько граммов фосфора необходимо для получения 71 г оксида фосфора (5)?
Дано:
m(P₂O₅)=71г.
m(P)-?
1. M(P₂O₅)=31x2+16x5=142г./моль
2. n(P₂O₅)=m(P₂O₅)÷M(P₂O₅)=0,5моль
3. 4P+5O₂=2P₂O₅
n(P₂O₅)=2моль - n(P)=4моль
n(P₂O₅)=0,5моль - n(P)=1моль
4. M(P)=31г./моль m(P)=n(P)хM(P)=1мольх31моль=31г.
5. ответ: 31г.
4. Напишите уравнение реакции по схеме:
Кислота + основание = соль + вода
HCI + NaOH=NaCI + H₂O
Вариант2
1. Расставьте коэффициенты в уравнениях реакций. Укажите тип реакции:
а) Al₂O₃+6HCl=2AlCI₃+3H₂O реакция обмена
б) FeSO₄+KOH=Fe(OH)₂↓+K₂SO₄ реакция обмена
в) 2NaNO₃=2NaNO₂+O₂↑ реакция разложения, окислительно-восстановительная
г) CO₂+C=CO↑ реакция соединения, окислительно-восстановительная.
2. составьте уравнения реакций, расставьте коэффициенты:
а) оксид серы (4)+вода = сернистая кислота
SO₂ +H₂O=H₂SO₃
б) серная кислота+цинк = сульфат цинка+водород
H₂SO₄ + Zn = ZnSO₄ + H₂↑
в) гидроксид железа (2)= оксид железа (2)+вода
Fe(OH)₂ +t= FeO + H₂O
3. Cколько граммов цинка необходимо для получения 56г оксида цинка?
Дано:
m(ZnO)=56г.
m(Zn)-?
1. M(ZnO)=65+16=81г./моль
2. n(ZnO)=m(ZnO)÷M(ZnO)= 56г.÷81г./моль=0,69моль
3. 2Zn+O₂ =2ZnO
n(ZnO)=2моль - n(Zn)=2моль
n(ZnO)=0,69моль - n(Zn)=0.69моль
4. M(Zn)=65г./моль m(Zn)=n(Zn)хM(Zn)=0.69мольх65моль=44,85г.
5. ответ: 44,85г.