Наибольшим сродством к электрону обладает фтор.
Объяснение:
Заметна тенденция увеличения значения сродства к электрону по продвижению по периоду.
Эту тенденцию можно объяснить с точки зрения эффективного заряда ядра: двигаясь в пределах периода, происходит увеличение эффективного заряда ядра, если электрон чувствует значительное притяжение к ядру, то при его добавлении к нейтральному атому будет выделяться больше энергии.
Таким образом, энергия, выделяемая при добавлении электрона к нейтральным атомам азота, кислорода и фтора будет равна: 0; -141; -328 кДж/моль, соответственно. Видно, что переходе от азота к фтору, выделяется больше энергии, поэтому фтор имеет наибольшее значение электронного сродства.
Вы обратили внимание, что выделяемая азотом энергия, при добавлении к нему электрона, равна 0, это легко объясняется, если расписать электронную конфигурацию данного атома:
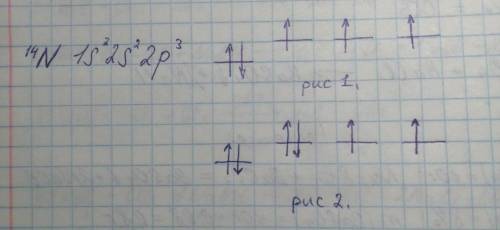
Электронная конфигурация атома азота представлена на рисунке.
На рис 1. изображены S и P орбитали нейтрального атома азота, по два электрона на S-орбитали и по одному на P-орбиталях.
На рис 2. иллюстрируется добавление электрона к нейтральному атому азота, он будет добавлен на одну из P-орбиталей, на которых уже есть электрон.
Таким образом, электрон, добавленный на одну из этих орбиталей будет отталкиваться от уже находящегося на орбитали электрона. Это и является причиной того, что тенденция непоследовательна - у азота нет сродства к добавленному электрону.