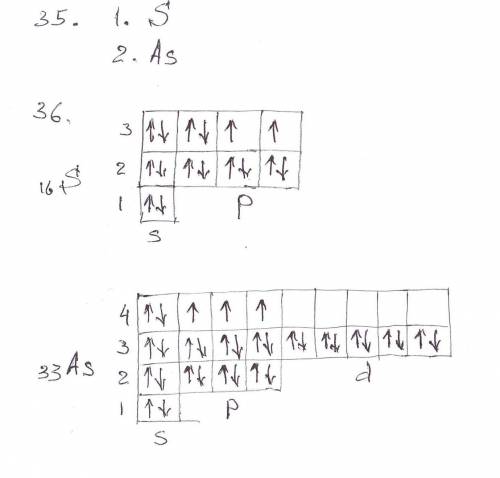
36. Дописать название подуровня и его номер. Записать химический знак элемента и перед ним поставить его порядковый номер. (См. в файл)
37. Номеру данного периода.
38. Номеру группы.
39. Количеством валентных электронов, т.е. электронов на внешнем слое.
40. Изменением строения их электронных оболочек. В каждом периоде происходит заполнение электронами внешнего энергетического уровня до восьми. Следовательно, электронные конфигурации наружных энергетических уровней периодически повторяются.
41. s-элементы - это элементы главной подгруппы I и II групп. По факту это элементы у которых заполняется s-уровень. В каждом периоде по 2 s-элемента.
42. р-элементы - это элементы III-VIII групп, главных подгрупп. Это элементы у которых заполняется р-уровень. Всего 6 р-элементов в каждом периоде (кроме первого, их там нет; и седьмого - хотя там тоже их 6 штук).
43. d-элементы - это элементы I-VIII групп, побочных подгрупп. Это элементы у которых заполняется d-уровень. В каждом большом периоде по 10 d-элементов.
Объяснение:
хоть это не то ,но надо так делать
Пример:
найди отношение масс элементов в воде.
Известно, что молекула воды состоит из 2 атомов водорода и 1 атома кислорода.
В Периодической таблице находим относительные атомные массы элементов:
Ar(H)=1Ar(O)=16.
Массу атомов элемента можно найти, если умножить число его атомов на атомную массу.
Определяем отношение масс:
m(H):m(O)=2⋅Ar(H)1⋅Ar(O)=2⋅11⋅16=18=1:8.
Масса водорода относится к массе кислорода как 1:8.
Определение отношения чисел атомов элементов в веществе
Если известно отношение масс элементов в веществе, то можно определить отношение чисел атомов.