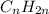Жиры являются главной составной частью животных жиров и растительных масел, присутствуют во всех животных и многих растительных тканях, особенно в семенах масличных культур (подсолнечника, оливы, всех орехов), входят в состав клеточных мембран и обеспечивают энергетический баланс в живых организмах. Для человека и многих животных являются одним из основных питательных компонентов.
Животные жиры при нормальных условиях - твердые вещества, имеющие невысокие температуры плавления. Животные жиры входят не только в состав жировой ткани, но также в больших количествах присутствуют в молоке и молочных продуктах (твороге, сметане, сыре, сливочном масле).
м1) Полученный газ объемом 5 мл - это избыток O2: этот объем не может сос-ть H2 - даже если бы 20 мл сос-л искл-но H2, то для его полного сгорания по ур-ю р-ии: а) H2 + 0.5O2 = H2O потр-ся бы O2 объемом 20*0.5 = 10 мл;
2) ур-е р-ии сгор-я CH4: а) CH4 + 2O2 = CO2 + 2H2O; пусть в смеси H2 и CH4 х мл H2 на сгорание кот-го треб-ся в соот-ии с 1а) 0.5*х мл O2 и 20-x мл CH4 на сгор-е кот-го треб-ся соот-но (20-х)*2 = 40-2*х мл O2;
3) с учетом условия о конд-ии водяных паров, поглощении CO2 оксидом кальция и объема газа 5 мл, а также в соот-ии с 1) и 2) пол-м равенство 30-(0.5*х+40-2*х) = 5, откуда х = 10 мл;
4) т.о. а исх-й смеси H2 и CH4 сод-сь 10 мл H2 и 20-10 = 10 мл CH4 с равными объемными долями (10/20)*100 = 50%.м1) Полученный газ объемом 5 мл - это избыток O2: этот объем не может сос-ть H2 - даже если бы 20 мл сос-л искл-но H2, то для его полного сгорания по ур-ю р-ии: а) H2 + 0.5O2 = H2O потр-ся бы O2 объемом 20*0.5 = 10 мл;
2) ур-е р-ии сгор-я CH4: а) CH4 + 2O2 = CO2 + 2H2O; пусть в смеси H2 и CH4 х мл H2 на сгорание кот-го треб-ся в соот-ии с 1а) 0.5*х мл O2 и 20-x мл CH4 на сгор-е кот-го треб-ся соот-но (20-х)*2 = 40-2*х мл O2;
3) с учетом условия о конд-ии водяных паров, поглощении CO2 оксидом кальция и объема газа 5 мл, а также в соот-ии с 1) и 2) пол-м равенство 30-(0.5*х+40-2*х) = 5, откуда х = 10 мл;
4) т.о. а исх-й смеси H2 и CH4 сод-сь 10 мл H2 и 20-10 = 10 мл CH4 с равными объемными долями (10/20)*100 = 50%.м1) Полученный газ объемом 5 мл - это избыток O2: этот объем не может сос-ть H2 - даже если бы 20 мл сос-л искл-но H2, то для его полного сгорания по ур-ю р-ии: а) H2 + 0.5O2 = H2O потр-ся бы O2 объемом 20*0.5 = 10 мл;
2) ур-е р-ии сгор-я CH4: а) CH4 + 2O2 = CO2 + 2H2O; пусть в смеси H2 и CH4 х мл H2 на сгорание кот-го треб-ся в соот-ии с 1а) 0.5*х мл O2 и 20-x мл CH4 на сгор-е кот-го треб-ся соот-но (20-х)*2 = 40-2*х мл O2;
3) с учетом условия о конд-ии водяных паров, поглощении CO2 оксидом кальция и объема газа 5 мл, а также в соот-ии с 1) и 2) пол-м равенство 30-(0.5*х+40-2*х) = 5, откуда х = 10 мл;
4) т.о. а исх-й смеси H2 и CH4 сод-сь 10 мл H2 и 20-10 = 10 мл CH4 с равными объемными долями (10/20)*100 = 50%.
1.Сначала найдем через относительную плотность молекулярную массу вещества:
2.Теперь найдем массы Углерода и Водорода за массами продуктов горения:
а)масса Углерода:
44 г углекислого газа содержит 12 г Углерода,а
6,6 г________________________х г, откуда х=6,6*12/44=1,8 г
б)масса Водорода:
18 г воды содержит 2 г Водорода,а
2,7 г_____________у г, откуда у=2*2,7/18=0,3 г
3.Если сложить полученные массы,то получится 2,1 г,значит это углеводород.так как действительно состоит из атомов Водорода и Углерода(если бы этой суммы не хватало бы,то разница между массой вещества и этими двумя массами элементов,дало бы массу третьего элемента,Кислорода,это на будущее).Теперь поделив каждую массу элемента на массу всего вещества,получим массовые доли этих элементов:
w(C)=1,8/2,1=0,8571 или 85,71%
w(H)=100% - w(C)=100 - 85,71=14,29%
4.Теперь осталось найти количество атомов каждого из элементов в веществе.Для этого необходимо вспомнить формулу по определению массовой доли элемента в веществе и вывести из нее n:
n(C)=Mr(CxHy)*w(C)/Ar(C)*100%=84,1*85,71/12*100=6
n(H)=Mr(CxHy)*w(H)/Ar(H)*100%=84,1*14,29/1*100=12
Вот и выходит,что формула углеводорода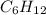 -это гексен - представитель непредельных углеводородов ряда этилена,так как подходит под общую формулу
-это гексен - представитель непредельных углеводородов ряда этилена,так как подходит под общую формулу