Объяснение:
Мы знаем по работам других людей, что вода состоит из H и O, доказать мы это сможем с электролиза: составим электрическую цепь с анодом и катодом из платины (для точности эксперимента), после чего нальём в ёмкость воды и пропустим через неё электрический ток, в результате на катоде будет выделяется водород, а на аноде кислород, что доказывается тем, что на катоде объём газа в 2 раза больше, так как атомов H в молекуле H2O больше, чем O в два раза. Теперь установим состав выделяющихся газов: в пробирку с газом с анода внесём палочку и слегка нагреем - палочка загорается, а значит этот газ. - кислород( поддерживает горение); газ с катода подвергнем горению - будет гореть равномерным голубоватым пламенем с характерным треском - этот газ водород.
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы) . Единица измерения количества вещества в СИ — моль.
n- количество вещества
n=m/M
n=v/Vm - только для газов при н. у
n=N/Na
n=PV/RT
m- масса
M - молярная масса
V - объем
Vm - молярный объем Vm=22,4 моль/л (@ 273К, 101325 Па)
N- число молекул
Na - число Авогадро Na=6,022*10^23 моль^-1
R - универсальная газовая постоянная R=8,314
P - давление
T - температура
Объяснение:
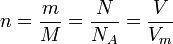
Na₂CO₃ + H₂SO₄ = Na₂SO₄ + H₂O + CO₂
m(BaSO₄)=2,33 г масса осадка
n(BaSO₄)=2,33/233=0,01моль
n(BaCl₂)=n(BaSO₄)=0,01моль
m(BaCl₂)=0,01моль*208г/моль=2,08г
m(Na₂CO₃)=12,68г-2,08г=10,6г
n(Na₂CO₃)=10,6г/106г/моль=0,1моль
по уравнениям реакций
n(H₂SO₄)=n(BaCl₂)+n(Na₂CO₃)=0,01+0,1=0,11моль
m(H₂SO₄)=0,11моль*98г/моль=10,78г