1)Уравнение реакции в общем виде: 4Ме + 3О2 = 2Ме2О3 Отношение количества вещества (Ме) к количеству вещества (Ме2О3) по уравнению реакции =4:2 или 2:1,следовательно (ню) Ме в 2 раза больше, чем Ме2О3. 2)Обозначим М (молярную массу Ме) через Х, тогда М (молярная масса оксида Ме2О3) будет равна 2Х +48 3)количество вещества Ме= м (масса 3г) / м (молярн. масса Х) = 3 / Х г/моль (а) количество вещества оксида = м (5,67г ) / М (2Х +48) =5,67 / 2х+48 г/моль (б) 4)Тогда, т. к. количество вещества Ме в 2 раза больше, следовательно, если значение (а) разделим на (б) = 2 3 / Х : (деление) 5,67 / 2Х +48 =2 3(2Х +48) :( 2Х ) х 5,67=2 6Х +144=11,34Х Х=27(г/моль) т. к. (Х) -молярная масса неизвестного металла, следовательно, это металл Аl(алюминий, степень окисления в оксиде у алюминия (+3),М =27 г моль.
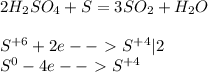
при Т=298°К идет прямая реакция.
Найти: а) знаки ΔН; ΔS; ΔG
б) знак изменения ΔG с ростом температуры
Решение:
Уравнение Гиббса ΔG = ΔH - TΔS показывает, что изменение свободной энергии зависит от изменения энтальпии (ΔН) и энтропии (ΔS) процесса.
1) По условию РЕАКЦИЯ ИДЕТ . Значит, при 298°К свободная энергия Гиббса меньше нуля, т.е. ΔG < 0
2) В левой части кристаллическое вещество и газ, в правой - только кристаллическое вещество. Значит, в левой части энтропия больше, т.к. там и молекул больше, и газ присутствует, энтропия которого всегда больше упорядоченного и имеющего структуру кристалла. Т.е. в процессе реакции ЭНТРОПИЯ УБЫВАЕТ. ΔS < 0.
Поскольку Т°К > 0, то для данного процесса (-ТΔS) > 0
3) Если энтропия против самопроизвольного протекания прямой реакции, а она по условию идет, значит, вклад (-ТΔS) по модулю меньше изменения энтальпии(ΔН), которая должна быть меньше нуля( чтобы изменение свободной энергии было меньше нуля).
ΔH - TΔS < 0;
|ΔH| > |-TΔS|;
ΔH < 0, т.е. прямая реакция экзотермическая (Q > 0)
3) С ростом температуры энтропийный фактор |-TΔS| будет возрастать по модулю, и результирующее изменение свободной энергии будет расти, т.е. по модулю уменьшаться.(станет менее отрицательным)
Когда энтропийный фактор данной реакции превысит энтальпийный, изменение свободной энергии будет больше 0. Т.е. рост температуры обратной реакции.
ответ: а) ΔH < 0; ΔS < 0; ΔG < 0
б) ΔG будет возрастать (убывать по модулю, поскольку по условию оно меньше нуля.),