Са1. число атомов всех элементов с формульной единицей al2(so4)2 1) 5 2) 7 3) 12 4) 17 а2. распределение электронов по энергетическим уровням 2е, 8е, соответствующей частицы 1) мg( вверху ноль) 2) na+ 3) na (вверху ноль) 4) ca 2- а3. группа формул веществ с ковалентной полярной связью 1) hcl, cacl2, h2 2)koh, h2s, co2 3) hi, p2o5, sf6 4) kno2, ph3, mgo а4. вещество с молекулярной кристаллической решеткой 1) оксид углерода 4 2) латунь 3) оксид кремния 4 4) хлорид натрия а5. вещества, между растворами которых возможна реакция обмена 1) нитрат натрия и карбонат калия 2) фосфорная кислота и хлорид натрия 3) карбонат натрия и азотная кислота 4) сульфат алюминия и соляная кислота а6. для осуществления превращений p2o3= ca3(po4)2=h3po4 необходимо последовательно использовать следующие реактивы 1)ca(oh)2 и h2co3 2) cacl2 и h2so4 3) cao и h2so4 4) cao и h2o а8. характеристика реакции, уравнение которой cu(oh)2=cuo+h2o 1)соединения, овр, эндотермическая 2) разложения, не овр, эндотермическая 3) разложения, овр, экзотермическая 4) замещения, не овр. экзотермическая а9. масса соли содержащейся в 300 г. 5%-го раствора соли, равна 1) 10 г 2) 15 г 3) 90 г 4) 150г а10. верны ли суждения об основаниях? а: щелочи реагируют с кислотными и кислотами с образованием соли и воды б: нерастворимые в воде основания при умеренном нагревании разлагаются 1) верно только а 2) верно только б 3) верны оба суждения 4) оба суждения неверны
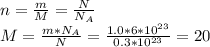
А1. ответ 4) 17.
В молекуле сульфата алюминия Al₂(SO₄)₃ атомов Al -2, S - 3, O - 4*3=12, всего 2 + 3 + 12 = 17.
А2. ответ 2) Na⁺
Заряд ядра атома натрия = +11, атом натрия имеет 11 электронов, расположенных на трех электронных уровнях (натрий в 3 периоде). Распределение электронов в атоме Na⁰ : 1s²2s²p⁶3s¹.
Когда атом натрия отдал 1 электрон, он превратился в ион Na⁺ : 1s²2s²p⁶3s⁰, т.е. имеет распределение электронов 2e8e.
А3. ответ 3)
Вещества состоят из элементов неметаллов. Химическая связь в них образована за счет общих электронных пар, которые смещены к более электроотрицательному элементу. Связь ковалентная полярная.
А4. ответ 1)
Оксид углерода (IV) - углекислый газ при температуре -78,3° превращается в твердое вещество - "сухой лед", имеющее молекулярную кристаллическую решетку.
А5. ответ 3)
Реакция обмена: Na₂CO₃ + 2HNO₃ → 2NaNO₃ + CO₂↑ + H₂O
А6. ответ 3)
P₂O₅ + 3CaO → Ca₃(PO₄)₂ ;
Ca₃(PO₄)₂ + 3H₂SO₄ → 3CaSO₄ + 2H₃PO₄
А8. ответ 2)
Cu(OH)₂ = CuO + H₂O реакция разложения, не окислительно-восстановительная, эндотермическая.
А9. ответ 2)
Масса соли в 300 г 5% раствора m = 300 * 0,05 = 15 г.
А10. ответ 1)
утверждение А - верно, утверждение Б - неверно.