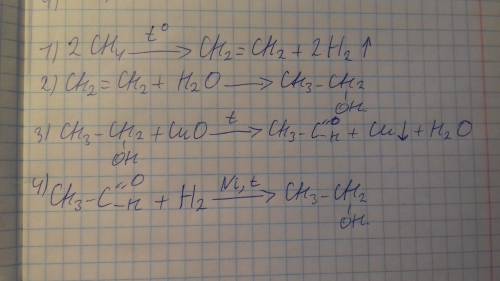
вот!
дано:
m(MgO)-8г
m(H2SO4)-19.8г
ришение
m=количество умножить на молярній обьем
а потом что бі найти количество = массу поделить на молярную массу, и у нас получаетсяя
MgO+2Y2so4=MgSo4+2H2O
8
V(MgO)=--- =.02 моль
40
19.8
V(H2SO4) = = 0,3 моль
50
V(MgO) 1
=
VH2SO4) 1
из этого у нас получается что 0,2< 0.3 моль из этого следует что H2SO4 в надлишку
потом
V(H2SO4) 2
=
V(MgSO4) 1
0.3
V(MgSO4)==0.15 моль
2
M(MgSO4)=24+32+(16умножить на 4)=120 г на моль
m(MgSO4)= 0.15 умножит 120=18 грам
вот и все
1) Находим массу 1 моля карбоната натрия:
М(Na₂CO₃) = 2*23 + 12 + 3*16 = 106 г/моль
2) Определяем, сколько молей составляет 4,48 л углекислого газа. Так как 1 моль любого газа при н.у. занимает объем 22,4 л, то 4,48 л составляют:
4,48/22,4 = 0,2 моль
3) Уравнение реакции:
Na₂CO₃ + 2HCl = 2NaCl + H₂O + CO₂↑
4) По уравнению реакции видно, что когда образуется 1 моль СО₂, то в реакцию вступает 1 моль карбоната натрия, значит доя образования 0,2 молей СО₂ в реакцию вступает 0,2 моль карбоната натрия или:
m( Na₂CO₃) = n * M = 0,2 * 106 = 21,2 г
5) Так как эта масса натрия карбоната содержится в растворе, то масса раствора равна:
m(p-p) = m( Na₂CO₃) / ω = 21,2/0,67 = 31,64 г
ответ: 31,64 г раствора карбоната натрия