ответ:
с)
объяснение:
азо́т (n, лат. nitrogenium) — элемент 15-й группы, второго периода периодической системы с атомным номером 7. относится к пниктогенам. как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха. один из самых распространённых элементов на земле. весьма инертен, однако реагирует с комплексными соединениями переходных металлов. основной компонент воздуха (78,09 % объёма), разделением которого получают промышленный азот (более ¾ идёт на синтез аммиака). применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент. азот — один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот.
свойства: бесцветный газ, без запаха и вкуса; малорастворим в воде: в 1 л h2o растворяется 15,4 мл n2 при t° = 20 °c и p = 1 атм; t кипения =-196 °c; t плавления =-210 °c. природный азот состоит из двух изотопов с атомными массами: 14 и 15.
свойства азота: атом азота имеет 7 электронов, из них 5 на внешнем уровне (5 валентных электронов). он является одним из самых электроотрицательных элементов (3,04 по шкале полинга), уступая лишь хлору (3.16), кислороду (3,44) и фтору (3,98).
характерная валентность – 3 и 4.
наиболее характерные степени окисления: -3, -2, -1, +2, +3, +4, +5, 0. в обычных условиях азот подобен инертному газу.
в обычных условиях азот непосредственно взаимодействует лишь с литием с образованием li3n. при нагревании (то есть активации молекул n2) или воздействии электрического разряда вступает в реакцию со многими веществами, обычно выступает как окислитель (азот по электроотрицательности на 3 месте после кислорода и фтора) и лишь при взаимодействии со фтором и кислородом – как восстановитель.
n2 + 3h2 ↔ 2nh3
n2 + 2b → 2bn
3si + 2n2 → si3n4
3ca + n2 → ca3n2
n2 + o2 → 2no.
получение азота. в промышленности азот получают путем сжижения воздуха с последующим испарением и отделением азота от других газовых фракций воздуха (перегонка). полученный азот содержит примеси благородных газов (аргона).
в лабораториях обычно используется азот, доставляемый с производства в стальных под повышенным давлением или жидкий азот в сосудах дьюара. можно получать азот разложением некоторых его соединений:
nh4no2 → n2 + 2h2o (при to)
(nh4)2cr2o7 → n2 + cr2o3 + 4h2o (при to)
2n2o → 2n2 + o2 (при to)
особо чистый азот получают термическим разложением азида натрия:
2nan3 → 2na + 3n2 (при to)
нахождение в природе: в природе азот встречается в основном в свободном состоянии. содержание азота в воздухе — его объемная доля 78,09 %. в небольшом количество соединения азота находится в почве; азот входит в состав аминокислот, образующих через посредство пептидных связей белки; содержится в молекулах нуклеиновых кислот – днк и рнк – в составе азотистых оснований (нуклеотидов): гуанина, аденила, тимидила, цитизила и уридила. общее содержание азота в земной коре – 0,01 %. из минералов промышленное значение имеют чилийская селитра nano3 и индийская селитра kno3.
1.Сначала найдем через относительную плотность молекулярную массу вещества:
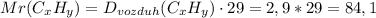
2.Теперь найдем массы Углерода и Водорода за массами продуктов горения:
а)масса Углерода:
44 г углекислого газа содержит 12 г Углерода,а
6,6 г________________________х г, откуда х=6,6*12/44=1,8 г
б)масса Водорода:
18 г воды содержит 2 г Водорода,а
2,7 г_____________у г, откуда у=2*2,7/18=0,3 г
3.Если сложить полученные массы,то получится 2,1 г,значит это углеводород.так как действительно состоит из атомов Водорода и Углерода(если бы этой суммы не хватало бы,то разница между массой вещества и этими двумя массами элементов,дало бы массу третьего элемента,Кислорода,это на будущее).Теперь поделив каждую массу элемента на массу всего вещества,получим массовые доли этих элементов:
w(C)=1,8/2,1=0,8571 или 85,71%
w(H)=100% - w(C)=100 - 85,71=14,29%
4.Теперь осталось найти количество атомов каждого из элементов в веществе.Для этого необходимо вспомнить формулу по определению массовой доли элемента в веществе и вывести из нее n:
n(C)=Mr(CxHy)*w(C)/Ar(C)*100%=84,1*85,71/12*100=6
n(H)=Mr(CxHy)*w(H)/Ar(H)*100%=84,1*14,29/1*100=12
Вот и выходит,что формула углеводорода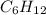 -это гексен - представитель непредельных углеводородов ряда этилена,так как подходит под общую формулу
-это гексен - представитель непредельных углеводородов ряда этилена,так как подходит под общую формулу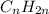
б) атомы металлов в соеденениях имеют только положительные степени окисления