1) 13,44 л
2) 9,6 г
Объяснение:
1) Формула: 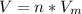 , где n - количество вещества (моль);
, где n - количество вещества (моль); 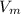 - молярный объем, который для всех газов при нормальных условиях равен 22,4 л/моль
- молярный объем, который для всех газов при нормальных условиях равен 22,4 л/моль
Подставляем и решаем: 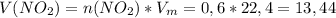 л
л
2) Формула количества молекул: 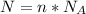 , где N - число молекул; n - количество вещества (моль);
, где N - число молекул; n - количество вещества (моль); 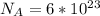 - число Авогадро (1/моль).
- число Авогадро (1/моль).
Из этой формулы нужно найти количество вещества → 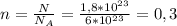 моль
моль
Далее используем формулу: 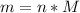 , где M - молярная масса вещества (г/моль)
, где M - молярная масса вещества (г/моль)
Молярная масса считается как сумма атомных масс элементов, входящих в вещество. Атомные массы даны в таблице Менделеева.
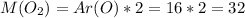 г/моль
г/моль
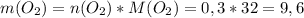 г
г
m(техн CaC2)=33.7 g
W(прим)=5%
η=90%
m(C2H2)-?
m(CaC2)=33.7 - (33.7*5%/100%)=32. g
32 X
CaC2+H2O-->Ca(OH)2+C2H2
64 26
M(CaC2)=64 g/mol M(C2H2)=26 g/mol
X=32*26/64=13 g - теоретическая масса
m(практ)=m(теор)*η / 100% = 13*90/100=11.7 g
ответ 11.7 г