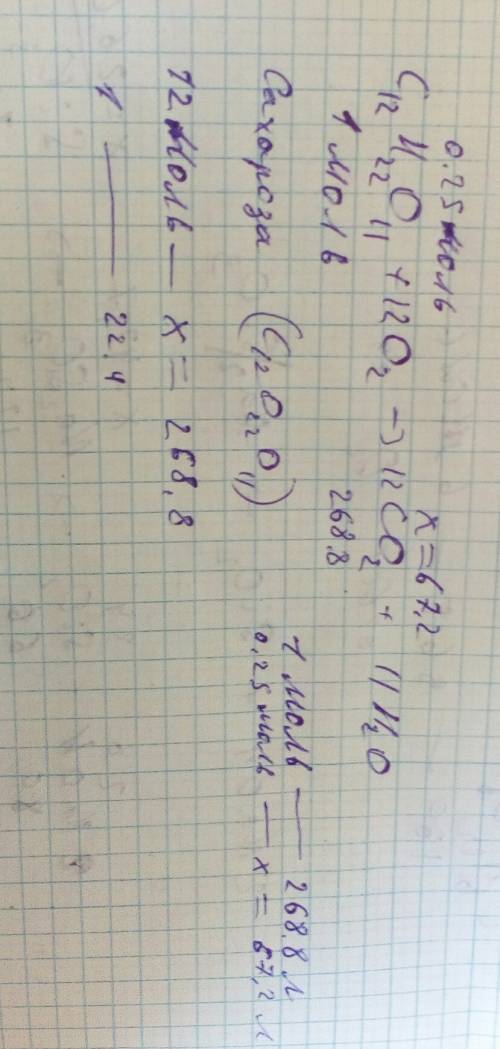
IceDex
5 - 9 классы Химия 43+22 б
Смещение химического равновесия
Химическое равновесие — состояние химической системы, в
котором обратимо протекает одна или несколько химических реакций, причём скорости в
каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в
химическом равновесии, концентрации реагентов, температура и другие параметры
системы не изменяются со временем.
Мы как раз рассмотрим влияние на химическое равновесие трех
факторов: концентрации, температуры и давления.
Принцип Ле Шателье:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее
воздействие (изменять температуру, давление, концентрации веществ), то
положение равновесия смещается в такую сторону, чтобы ослабить внешнее
воздействие. Увеличение концентрации реагентов смещает химическое равновесие в сторону
продуктов реакции как в газовой, так и в жидкой среде. Удаление продуктов из среды реакции так же смещает равновесие в сторону
продуктов реакции. Увеличение концентрации продуктов смещает химическое равновесие в сторону
обратной реакции.
в эндотермической реакции -Q: увеличение температуры смещает равновесие в сторону продуктов (прямой реакции); уменьшение температуры смещает равновесие в сторону реагентов (обратной
реакции);
в экзотермической реакции +Q: увеличение температуры смещает равновесие в сторону реагентов (обратной реакции); уменьшение температуры смещает равновесие в сторону продуктов (прямой реакции); При увеличении давления равновесие смещается в сторону меньшего объема (в данном
примере 4 моль → 2 моль, т.е. равновесие сместится в сторону продукта реакции -
образования аммиака). При уменьшении давления — в сторону большего объема (в сторону обратной реакции)
Если в реакции участвуют твердые вещества, например: 2C (тв) + O2 (г) ↔ 2CO (г), то их
количество не учитывается. Если объем (количество веществ) смеси не меняется, то изменение давления не будет
оказывать влияние на смещение химического равновесия. Катализаторы не влияют на смещение химического равновесия!
Объяснение: