Начнем - с.
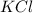 - соль сильного основания - KOH, и сильной кислоты - HCl - гидролизу не подвергается.
- соль сильного основания - KOH, и сильной кислоты - HCl - гидролизу не подвергается.
 - соль сильного основания - KOH, и слабой кислоты -
- соль сильного основания - KOH, и слабой кислоты - 
Гидролиз пойдет по аниону - 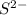
1 - ступень:
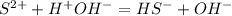 Гидроксид - аноины говорят нам о том, что среда - щелочная - лакмус синий
Гидроксид - аноины говорят нам о том, что среда - щелочная - лакмус синий
Молекулярный Вид: 
2 - ступень:
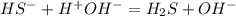 - снова щелочная среда, лакмус - синий
- снова щелочная среда, лакмус - синий
Молекулярный вид: 
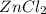 - соль слабого основания -
- соль слабого основания - 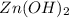 , сильной кислоты - HCl
, сильной кислоты - HCl
гидролиз пойдет по катиону - 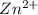
1 - ступень:
 <- катионы водорода говорят нам о том, что среда раствора кислая, лакмус - красный.
<- катионы водорода говорят нам о том, что среда раствора кислая, лакмус - красный.
МВ: 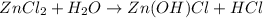
2 - ступень:
 <- снова катиончики водорода говорят нам о том, что среда кислая, а лакмус краснеет.
<- снова катиончики водорода говорят нам о том, что среда кислая, а лакмус краснеет.
МВ: 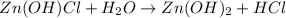
 - соль слабого основания, сильной кислоты - гидолизируется по катиону:
- соль слабого основания, сильной кислоты - гидолизируется по катиону:
1 - ступень:
 <- катионы водорода, говорят нам о том, что среда кислая, лакмус - красный.
<- катионы водорода, говорят нам о том, что среда кислая, лакмус - красный.
МВ: 
2 - ступень:
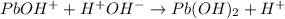 <- среда кислая, лакмус - красный
<- среда кислая, лакмус - красный
МВ: 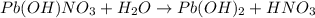
 - соль сильного основания, слабой кислоты, гидролиз по аниону.
- соль сильного основания, слабой кислоты, гидролиз по аниону.
1 - ступень:
 среда щелочная, лакмус синий
среда щелочная, лакмус синий
МВ: 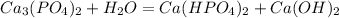
2 - ступень:
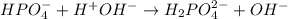
МВ: 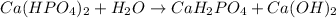
3 - ступень:

МВ: 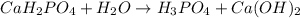 среда щелочная, лакмус синий
среда щелочная, лакмус синий
 - соль сильного основания, слабой кислоты - гидролиз по аниону.
- соль сильного основания, слабой кислоты - гидролиз по аниону.
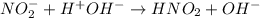 <- гидроксид - анионы угазывают на щелочной характер среды, лакмус синеет.
<- гидроксид - анионы угазывают на щелочной характер среды, лакмус синеет.
МВ: 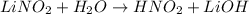
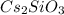 - соль сильного основания, слабой кислоты, гидролиз по аниону:
- соль сильного основания, слабой кислоты, гидролиз по аниону:
1 - ступень:
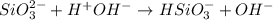 <- снова среда щелочная, лакмус синий
<- снова среда щелочная, лакмус синий
МВ: 
2 ступень:
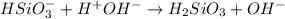
МВ: 
 - соль сильной кислоты, слабого основания, гидролиз по катиону:
- соль сильной кислоты, слабого основания, гидролиз по катиону:
1 - ступень:
 среда кислая, лакмус красный
среда кислая, лакмус красный
МВ: 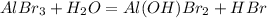
2 - ступень:
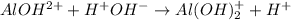
МВ: 
3 - ступень

МВ: 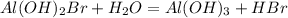
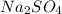 - соль сильного основания, сильной кислоты - гидролизу не подвергается, среда - нейтральная, лакмус - фиолетовый
- соль сильного основания, сильной кислоты - гидролизу не подвергается, среда - нейтральная, лакмус - фиолетовый
2C₁₇H₃₅COO⁻ + 2Na⁺ + Ca²⁺ + 2NO₃⁻ => (C₁₇H₃₅COO)₂Ca↓ + 2Na⁺ + 2NO₃⁻
C₁₇H₃₅COO⁻ + Ca²⁺ => (C₁₇H₃₅COO)₂Ca↓
С₁₇H₃₅COONa + HCl => C₁₇H₃₅COOH↓ + NaCl
C₁₇H₃₅COO⁻ + Na⁺ + H⁺ + Cl⁻ => C₁₇H₃₅COOH↓ + Na⁺ + Cl⁻
C₁₇H₃₅COO⁻ + H⁺ => C₁₇H₃₅COOH↓
2C₁₇H₃₅COONa + (CH₃COO)₂Mg = (C₁₇H₃₅COO)₂Mg↓ + 2CH₃COONa
2C₁₇H₃₅COO⁻ + 2Na⁺ + 2CH₃COO⁻ + Mg²⁺ = (C₁₇H₃₅COO)₂Mg↓ +
+ 2CH₃COO⁻ + 2Na⁺
2C₁₇H₃₅COO⁻ + Mg²⁺ = (C₁₇H₃₅COO)₂Mg↓