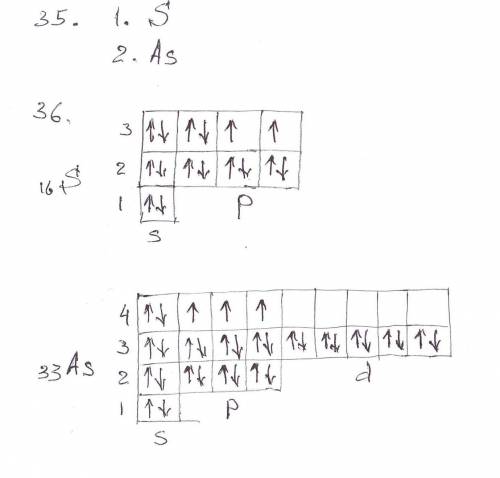
36. Дописать название подуровня и его номер. Записать химический знак элемента и перед ним поставить его порядковый номер. (См. в файл)
37. Номеру данного периода.
38. Номеру группы.
39. Количеством валентных электронов, т.е. электронов на внешнем слое.
40. Изменением строения их электронных оболочек. В каждом периоде происходит заполнение электронами внешнего энергетического уровня до восьми. Следовательно, электронные конфигурации наружных энергетических уровней периодически повторяются.
41. s-элементы - это элементы главной подгруппы I и II групп. По факту это элементы у которых заполняется s-уровень. В каждом периоде по 2 s-элемента.
42. р-элементы - это элементы III-VIII групп, главных подгрупп. Это элементы у которых заполняется р-уровень. Всего 6 р-элементов в каждом периоде (кроме первого, их там нет; и седьмого - хотя там тоже их 6 штук).
43. d-элементы - это элементы I-VIII групп, побочных подгрупп. Это элементы у которых заполняется d-уровень. В каждом большом периоде по 10 d-элементов.
Объяснение:
2SO₂ + O₂ (t,кат.)= 2SO₃
SO₃ + H₂O = H₂SO₄
H₂SO₄ + CuO = CuSO₄ + H₂O
CuSO₄ + 2KOH = Cu(OH)₂↓ + K₂SO₄
Be(OH)₂ - гидроксид бериллия, амфотерное вещество, реагирует и с кислотами и со щелочами:
Be(OH)₂ + 2HNO₃ = Be(NO₃)₂ + 2H₂O
Be(OH)₂ + 2NaOH = Na₂[Be(OH)₄]