Объяснение:
Ca₃(P⁺⁵O₄)₂ + 3SiO₂ + 5C⁰ = 3CaSiO₃ + 2P⁰ + 5C⁺²O
Р⁺⁵ + 5е⁻ = Р⁰ | 2 - окислитель, процесс восстановления
С⁰ - 2е⁻ = С⁺² | 5 - восстановитель, процесс окисления
2. 3Fe⁺²O + 10HN⁺⁵O₃= 3Fe⁺³(NO₃)₃ + N⁺²O + 5H₂O
Fe⁺² - е⁻ = Fe⁺³ | 3 - восстановитель, процесс окисления
N⁺⁵ + 3e⁻ = N⁺² | 1 - окислитель, процесс восстановления
3. 12HCI⁻¹ + 2Cr⁺⁶O₃ = 3CI₂⁰ + 2Cr⁺³CI₃ + 6H₂O
2Cl⁻¹ - 2e⁻ = Cl₂⁰ | 3 - восстановитель, процесс окисления
Cr⁺⁶ + 3e⁻ = Cr⁺³ | 2 - окислитель, процесс восстановления
4. 6HCI⁻¹ + KCI⁺⁵O₃ = 3CI₂⁰ + KCI⁻¹ + 3H₂O
2Cl⁻¹ - 2e⁻ = Cl₂⁰ | 3 - восстановитель, процесс окисления
Cl⁺⁵ + 6e⁻ = Cl⁻¹ | 1 - окислитель, процесс восстановления
5. 5KI⁻¹ + KI⁺⁵O₃ + 3H₂SO₄ = 3I₂⁰+ 3K₂SO₄ + 3H₂O
2I⁻¹ - 2e⁻ = I₂⁰ | 5 - восстановитель, процесс окисления
2I⁺⁵ + 10e⁻ = I₂⁰ | 1 - окислитель, процесс восстановления
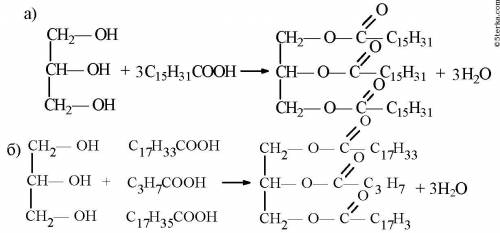
1)а)это с пальмитиновой кислотой,б)это с олеиновой, масляной и стеариновой кислотами.
2)Сложные эфиры — органические вещества, производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал. Их состав соответствует общей формуле
3)Животные жиры, в основном, состоят из смеси глицеридов стеариновой и пальмитиновой кислоты. Такие масла могут долго храниться на воздухе, не меняя своей консистенции, и потому называются «невысыхающими».
Жидкие жиры (масла, содержащие олеиновую, линолевую и линоленовую кислоты), взаимодействуя с кислородом воздуха образовывать твердые пленки – «сшитые полимеры». Такие масла называют «высыхающими». Они служат основой для натуральной олифы и красок.
Например, льняное масло содержит глицерид ненасыщенной линолевой кислоты. При нанесении тонким слоем на поверхность такое масло под действием кислорода воздуха высыхает в ходе полимеризации по двойным связям, при этом образуется эластичная пленка, не растворимая в воде и органических растворителях.
Значительное количество твердых и мягких технических жиров добавляют в корма животных, чтобы улучшить вкус кормов и облегчить их гранулирование.
Животные жиры и масла представляют собой сырье для получения высших карбоновых кислот, моющих средств и глицерина.
1. Основные оксиды взаимодействуют с водой с образованием оснований. Условие протекания реакции: должны образовываться растворимые основания!
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2Al2O3 + H2O → реакция не протекает, так как должен образовываться Al(OH)3, который нерастворим.
2. Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2 → CaSiO34. Взаимодействие с амфотерными оксидами:
СaO + Al2O3 → Сa(AlO2)2Кислотные оксиды
Химические свойства кислотных оксидов1. Взаимодействие с водой с образованием кислоты:
Условия протекания реакции: должна образовываться растворимая кислота.P2O5 + 3H2O → 2H3PO4
2. Взаимодействие со щелочами с образованием соли и воды:Условия протекания реакции: с кислотным оксидом взаимодействует именно щелочь, то есть растворимое основание.SO3 + 2NaOH → Na2SO4 + H2O
3. Взаимодействие с основными оксидами с образованием солей:
SO3 + Na2O → Na2SO4